
【题目】我们的生活离不开铁元素。从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的司南是由天然磁石制成的,其主要成分是______(填化学式)。
(2)现代利用铁的氧化物循环裂解水制氢气的过程如下图所示。
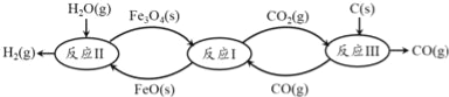
①已知:3FeO(s)+CO2(g)![]() Fe3O4(s)+CO(g)△H1═ —19.3kJmol﹣1
Fe3O4(s)+CO(g)△H1═ —19.3kJmol﹣1
Fe3O4(s)+H2(g)![]() 3FeO(s)+H2O(g)△H2═+57.2kJmol﹣1
3FeO(s)+H2O(g)△H2═+57.2kJmol﹣1
C(s)+CO2(g)![]() 2CO(g)△H3═ +172.4kJmol﹣1
2CO(g)△H3═ +172.4kJmol﹣1
铁氧化物循环裂解水制氢气总反应的热化学方程式是
C(s)+H2O(g)═H2(g)+CO(g)△H═_____________ 。
②整个过程与温度密切相关,当温度低于570℃时,Fe3O4(s)和CO(g)反应得到的产物是Fe(s)和CO2(g),阻碍循环反应的进行。下图表示其他条件一定时,Fe3O4(s)和CO(g)反应达平衡时CO(g)的体积百分含量随温度的变化关系。

i.反应Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g)△H______0(填“>”、“<”或“=”),理由是______。
3Fe(s)+4CO2(g)△H______0(填“>”、“<”或“=”),理由是______。
ii.在低于570℃的某温度时,发生上述反应,增加CO浓度,C(CO)/C(CO2)比值_______(填“增大”“减小”“不变”)。
(3)①18世纪有一个名叫狄斯巴赫的德国人,他是制造和使用涂料的工人,因此对各种有颜色的物质都感兴趣。他实验合成出古老而神奇的蓝色染料普鲁士蓝。他的合成方法如下:
复分解反应ii的化学方程式为______。
②利用普鲁士蓝合成原理也可以用于检测食品中CN﹣,通过试纸变蓝与否则证明食品中含有CN﹣,检测过程方案如下:
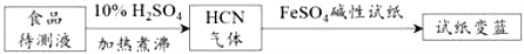
FeSO4碱性试纸用于检测HCN的工作原理为__________________________。
【答案】 Fe3O4 +134.5 kJmol﹣1 < 当其他条件一定时,温度升高,CO的体积百分含量增大,可逆反应Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g) 逆向移动,故△H<0 不变 3K4Fe(CN)6 + 4FeCl3 = Fe4[Fe(CN)6]3 + 12KCl 碱性条件下,Fe2+与CN﹣结合生成[Fe(CN)6]4-;Fe2+被空气中O2氧化生成Fe3+;[Fe(CN)6]4- 与Fe3+反应生成普鲁士蓝使试纸显蓝色
3Fe(s)+4CO2(g) 逆向移动,故△H<0 不变 3K4Fe(CN)6 + 4FeCl3 = Fe4[Fe(CN)6]3 + 12KCl 碱性条件下,Fe2+与CN﹣结合生成[Fe(CN)6]4-;Fe2+被空气中O2氧化生成Fe3+;[Fe(CN)6]4- 与Fe3+反应生成普鲁士蓝使试纸显蓝色
【解析】(1)古代中国四大发明之一的司南是由天然磁石制成的,磁铁成分主要是四氧化三铁,化学式为Fe3O4;(2)①Ⅰ.Fe3O4(s)+CO(g)![]() 3FeO(s)+CO2(g)△H1═-19.3kJmol﹣1
3FeO(s)+CO2(g)△H1═-19.3kJmol﹣1
Ⅱ. Fe3O4(s)+H2(g)![]() 3FeO(s)+H2O(g)△H2═+57.2kJmol﹣1
3FeO(s)+H2O(g)△H2═+57.2kJmol﹣1
Ⅲ.C(s)+CO2(g)![]() 2CO(g)△H3═+172.4kJmol﹣1
2CO(g)△H3═+172.4kJmol﹣1
依据盖斯定律计算Ⅲ-Ⅰ-Ⅱ得到铁氧化物循环裂解水制氢气总反应的热化学方程式;C(s)+H2O(g)═H2(g)+CO(g)△H═+134.5 kJmol﹣1;②i.当温度低于570℃时,Fe3O4(s)和CO(g)反应得到的产物是Fe(s)和CO2(g),阻碍循环反应的进行,图象分析可知,随温度升高CO体积分数增大,说明达到平衡状态后,升温平衡逆向进行,正反应为放热反应,△H<0;ii.低于570°C某温度时,发生反应Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g),该反应的平衡常数表达式为K=C4(CO2)/C4(CO),平衡常数仅受温度影响,温度变,平衡常数变,温度不变,平衡常数不变,温度不变时C(CO2)/C(CO)不变,不受CO浓度影响,则C(CO) / C(CO2)不变;(3)①[Fe(CN)6]4-和Fe3+反应生成Fe4[Fe(CN)6]3蓝色沉淀,反应的化学方程式为:3K4Fe(CN)6 + 4FeCl3 = Fe4[Fe(CN)6]3 + 12KCl;②基于普鲁士蓝合成原理可检测食品中CN﹣,碱性条件下,Fe2+与CN﹣结合生成[Fe(CN)6]4-;Fe2+被空气中O2氧化生成Fe3+;[Fe(CN)6]4-与Fe3+反应生成普鲁士蓝使试纸显蓝色。
3Fe(s)+4CO2(g),该反应的平衡常数表达式为K=C4(CO2)/C4(CO),平衡常数仅受温度影响,温度变,平衡常数变,温度不变,平衡常数不变,温度不变时C(CO2)/C(CO)不变,不受CO浓度影响,则C(CO) / C(CO2)不变;(3)①[Fe(CN)6]4-和Fe3+反应生成Fe4[Fe(CN)6]3蓝色沉淀,反应的化学方程式为:3K4Fe(CN)6 + 4FeCl3 = Fe4[Fe(CN)6]3 + 12KCl;②基于普鲁士蓝合成原理可检测食品中CN﹣,碱性条件下,Fe2+与CN﹣结合生成[Fe(CN)6]4-;Fe2+被空气中O2氧化生成Fe3+;[Fe(CN)6]4-与Fe3+反应生成普鲁士蓝使试纸显蓝色。


科目:高中化学 来源: 题型:
【题目】环丁基甲酸是重要的有机合成中间体,其一种合成路线如下:

回答以下问题:
(1)A属于烯烃,其结构简式为____________________。
(2)B→C的反应类型是_________________,该反应生成的与C互为同分异构体的副产物是__________________(写结构简式)。
(3)E的化学名称是___________________________。
(4)写出D生成E的化学方程式_______________________________________________。
(5)H的一种同分异构体为丙烯酸乙酯(CH2=CH—COOC2H5),写出聚丙烯酸乙酯在NaOH溶液中水解的化学方程式_________________________________________________________。
(6)写出同时满足下列条件的G的所有同分异构体__________________________________。
(写结构简式,不考虑立体异构)。
①核磁共振氢谱为3组峰; ②能使溴的四氯化碳溶液褪色;
③1mol该同分异构体与足量饱和NaHCO3反应产生88g气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程发生了加成反应的是( )
A.乙烯使酸性高锰酸钾溶液褪色B.将四氯化碳滴入溴水中,振荡后水层接近无色
C.乙烯使溴水褪色D.甲烷与氯气混合光照,黄绿色消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值。
请回答下列问题:
(1)Ti的基态原子价电子排布式为______。
(2)纳米TiO2常用作下述反应的催化剂。

化合物甲的分子中采取sp2方式杂化的碳原子有_____________个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为___________________。
(3)含Ti3+的配合物的化学式为[TiCl(H2O)5]Cl2·H2O,其配离子中含有的化学键类型是____________,1 mol该配合物中含有的![]() 键数目是____________。
键数目是____________。
(4)通过X—射线探知KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似。且知三种 离子晶体的晶格能数据如下:

KCl、MgO、CaO、TiN四种离子晶体熔点由高到低的顺序为______________________。
(5)某种氮化钛晶体的晶胞如图所示,该晶体中与N原子距离相等且最近的N原子有_____个:Ti原子的配位数为______;此配位原子构成的空间构型为_____;该晶胞中N、Ti原子之间的最近距离为a nm。则该氮化钛晶体的密度为______g·cm-3、NA为阿伏加德罗常数的值,只列计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《茉莉花》是一首脍炙人口的江苏民歌。茉莉花香气的成分有多种,乙酸苯甲酯(![]() )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:

(1)B、C的结构简式分别为________、________。
(2)写出反应①、③、④的化学方程式:
①______________________________________________________________。
④______________________________________________________________。
③______________________________________________________________。
(3)反应①、③、④、⑤的反应类型分别为①______,③______,④_____,⑤_____。
(4)A中官能团的名称是___________,检验这种官能团除了可以用银氨溶液还可以用______________(填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应2NO2(g)![]() N2O4(g)在一恒容密闭容器内建立平衡,现向容器内再通入一定量纯净的NO2气体,则建立新平衡后c(NO2)/c(N2O4)的变化趋势是
N2O4(g)在一恒容密闭容器内建立平衡,现向容器内再通入一定量纯净的NO2气体,则建立新平衡后c(NO2)/c(N2O4)的变化趋势是
A. 增大 B. 减小 C. 不变 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下0.1mol/L的CH3COOH溶液加水稀释过程中,下列数值一定变小的是
A. c(H+) B. c (H+) /c(CH3COOH)
C. c (H+)·c(OH-) D. c(OH-)/c (H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极分别电解下列各物质的水溶液,一段时间后,向剩余电解质溶液中加入适量相应的溶质能使溶液恢复到电解前浓度的是
A. AgNO3 B. Na2SO4 C. CuCl2 D. KCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com