
【题目】现有下列五种物质:
A.食盐 B.食醋 C.苹果汁 D.葡萄糖 E.青霉素
请按下列要求填空(填序号,每空只填一个):
富含维生素C的是___;可直接进入血液,补充能量的是___;应用最广泛的抗生素之一的是___;食用过多会引起血压升高、肾脏受损的___。
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】下图是氯化钠晶体和二氧化碳晶体的结构示意图关于两种晶体说法正确的是 ( )
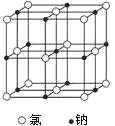
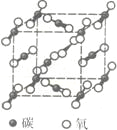
A. 两种晶体均以分子间作用力按一定规则排列组成
B. 构成两种晶体的微粒均是原子
C. 两者的硬度、熔沸点等物理性质与微粒间的作用力都有密切关系
D. 两种晶体均属于离子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是
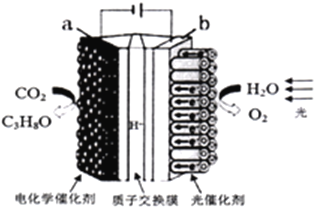
A. 该装置将化学能转化为光能和电能
B. a电极的反应为:3CO2+16H+-18e-=C3H8O+4H2O
C. 该装置工作时,H+从b极区向a极区迁移
D. 每生成1molO2有44gCO2被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:
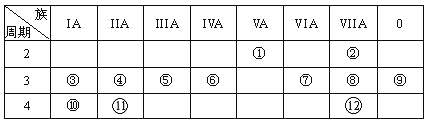
(1)画出原子的结构示意图:④______________
(2)在①~12元素中,非金属性最强的元素是____,最不活泼的元素是_____。(均填元素符号)
(3)元素⑦与元素⑧相比,非金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是________。
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(4)元素⑤的最高价氧化物的水化物分别与元素③⑧的最高价氧化物的水化物反应的离子方程式_________,
(5)第三周期中原子半径最大的元素跟它同周期原子半径最小的元素它们可以形成化合物,用电子式表示其形成过程:_____。
(6)已知某元素原子最外层电子数是其次外层电子数的2倍,该元素可以与⑧形成一种AB4型的化合物,请用电子式表示其形成过程:______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关油脂的叙述中不正确的是
A.油脂没有固定的熔点和沸点,故油脂是混合物
B.油脂是由高级脂肪酸和甘油所生成的酯
C.油脂是酯的一种
D.油脂都不能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓) ![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
③KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
试回答下列问题:
(1)当反应①转移3摩尔电子时,消耗H2SO4的质量是______g,产生氢气的体积(标准状况)_________L。
(2)反应②中_________作氧化剂,___________是氧化产物。
(3)当反应②中生成11.2LSO2气体(标准状况下)时,被还原的H2SO4的物质的量是____________。
(4)用单线桥法表示反应②电子转移的方向和数目(在化学方程式上标出)。___________
Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
(5)反应③中氧化产物与还原产物的物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。
N2+3H2![]() 2NH3
2NH3
现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生,下列有关说法正确的是( )
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正反应和逆反应的速率都为零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作和现象正确的是
操作 | 结论 | 现象 | |
A | 向 | 有气泡生成 | 非金属性Cl>S |
B | 溶有 | 有白色沉淀生成 | X一定是 |
C | 向稀硫酸酸化的 | 溶液变黄色 | 氧化性 |
D | 向稀硫酸中加入铜片,然后通入 | 先无明显现象,通入加热后变蓝 | 氧化性:稀硫酸 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com