
 ����0.8mol��ϡ������Һ����������22.4g�����ۣ����跴Ӧ��Ϊ�����Σ���һ��Ϊ��Fe+HNO3��Fe��NO3��3+NO��+H2O��
����0.8mol��ϡ������Һ����������22.4g�����ۣ����跴Ӧ��Ϊ�����Σ���һ��Ϊ��Fe+HNO3��Fe��NO3��3+NO��+H2O������ ��1������0.8mol��ϡ��������������22.4g�����ۣ�n��Fe��=$\frac{22.4g}{56g/mol}$=0.4mol��Fe����������ʵ���֮��Ϊ1��2�����߷�Ӧ��������������NO�����ٺ������ӷ�Ӧ�����������ӣ�
��2������ϡ������ܷ�ӦΪ3Fe+8H++2NO3-=3Fe2++2NO��+4H2O��0.8mol������ȫ��ȫ��Ӧ����0.3molFe����Ӧ���ܹ�������������ӵ����ʵ���Ϊ0.2mol����Ӧ��ʣ��0.6mol��������ӣ�
��ʼʱ���������������ӦFe+4HNO3=Fe��NO3��3+NO��+2H2O��0.8mol������ȫ��Ӧʱ��Fe3+�������ֵ���ɷ���ʽ��֪Fe3+��������ʵ�����
������ȫ��Ӧ������ӦΪ2Fe��NO3��3+Fe=3Fe��NO3��2�����ݷ���ʽ��֪Fe2+��������ʵ������ݴ˻���Fe2+��Fe3+��NO3-�����ʵ�����������۵����ʵ����仯�Ĺ�ϵͼ��
��� �⣺��1������0.8mol��ϡ��������������22.4g�����ۣ�n��Fe��=$\frac{22.4g}{56g/mol}$=0.4mol��Fe����������ʵ���֮��Ϊ1��2�����߷�Ӧ��������������NO�����ٺ������ӷ�Ӧ�����������ӣ����ӷ���ʽ�ֱ�Ϊ��Fe+4H++NO3-=Fe3++NO��+2H2O��2Fe3++Fe=3Fe2+��
�ʴ�Ϊ��Fe+4H++NO3-=Fe3++NO��+2H2O��2Fe3++Fe=3Fe2+��
��2������ϡ������ܷ�ӦΪ��3Fe+8H++2NO3-=3Fe2++2NO��+4H2O�����NO3-Ϊ0.8mol��0.8mol������ȫ��ȫ��Ӧ����0.3molFe����Ӧ���ܹ�������������ӵ����ʵ���Ϊ0.2mol����Ӧ��ʣ��0.6mol��������ӣ�
��ʼʱ���������������ӦΪ��Fe+4HNO3=Fe��NO3��3+NO��+2H2O��0.8mol������ȫ��Ӧʱ��Fe3+�������ֵ���ɷ���ʽ��֪Fe3+��������ʵ���Ϊ��0.8mol��$\frac{1}{4}$=0.2mol������FeΪ0.2mol��
������ȫ��Ӧ������ӦΪ��2Fe��NO3��3+Fe=3Fe��NO3��2�����ݷ���ʽ��֪Fe2+��������ʵ���Ϊ��0.2mol��$\frac{3}{2}$=0.3mol������FeΪ0.2mol��$\frac{1}{2}$=0.1mol��
����Fe2+��Fe3+��NO3-�����ʵ�����������۵����ʵ����仯�Ĺ�ϵͼ��Ϊ�� ��
��
�ʴ�Ϊ�� ��
��
���� ���⿼�������ӷ�Ӧ���㼰��Ӧ�ã���Ŀ�Ѷ��еȣ���ȷ������Ӧ��ʵ��Ϊ���ؼ���ע�������������ӷ���ʽ����дԭ������������ѧ���ķ������������Ӧ��������


 ���ƿ�����ϵ�д�
���ƿ�����ϵ�д� ���¿쳵����������ϵ�д�
���¿쳵����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������չ̫���ܺͷ���������ɻ�������������� | |
| B�� | ���ع��ͻ��ռӹ�Ϊȼ���ͣ������Դ�������� | |
| C�� | �ƹ�ʹ��һ����ľ�꣬���ټ�����Ⱦ | |
| D�� | �ƹ�ʹ�õ綯��������Ȼ�������Ȼ���������ͨ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����Ħ�����ԼΪ22.4L•mol-1 | |
| B�� | �ڱ�״���£�1mol�κ�������ռ�������ԼΪ22.4L | |
| C�� | HNO3��Ħ��������63g | |
| D�� | ����������Ħ��������ȣ�����98g/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Fe3+ ����I-������Ӧ | |
| B�� | F-ʹI-�Ļ�ԭ�Լ��� | |
| C�� | Fe3+ ��F-��ϳɲ���I-��Ӧ������ | |
| D�� | Fe3+ ��F-��ԭΪFe2+ʹ��Һ�в��ٴ���Fe3+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | K+��Br-��Cl-��SO42- | B�� | SCN-��Fe3+��Cl-��K+ | ||
| C�� | K+��Cu2+��SO42-��Na+ | D�� | Na+��ClO-��NO3-��SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SO2���������ԣ�������Ư��ֽ�� | |
| B�� | ������Һ��������ɫ�������ڼ���ⵥ�ʵĴ��� | |
| C�� | Fe�ڳ�������Ũ���ᷢ���ۻ���������������ʢ�����Ũ���� | |
| D�� | Zn���л�ԭ�Ժ͵����ԣ�������п�̸ɵ�صĸ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ĵ��뷽��ʽ����ЧӦ�ɱ�ʾΪ��HF��aq��?F-��aq��+H+��aq����H=+10.4 kJ•mol-1 | |
| B�� | NaFˮ��ʱ���Ȼ�ѧ����ʽΪF-��aq��+H2O��aq��=HF��aq��+OH-��aq����H=+67.7KJ•mol | |
| C�� | ��Һ�¶����ߺ�һ���ܴٽ�������ʵĵ��� | |
| D�� | ������0.1molHF��0.1molNaOH���������ʻ�Ϻ�ų�������Ϊ6.77KJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
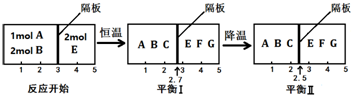
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com