
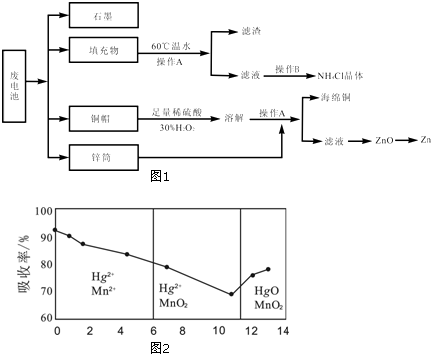
分析 (1)加热适当温度,可促进溶解,注意温度不能过高;
(2)操作A用于分离固体和液体;
(3)酸性条件下,双氧水能将铜氧化生成铜离子;加热条件下,双氧水易分解;
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2,其负极上锌失电子发生氧化反应;
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止.其主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4═3MnSO4+4CO2↑+6H2O.
①根据二氧化锰和转移电子之间的关系式计算;
②MnO(OH)与浓盐酸在加热条件下也可发生反应生成氯化锰、氯气和水;
(6)根据横坐标与其吸收率曲线变化趋势分析;酸性条件下,高锰酸钾具有强氧化性.
解答 解:(1)加热适当温度,可促进溶解,故答案为:加快溶解速率;
(2)分离不溶性固体和溶液采用过滤的方法,所以该操作名称是过滤,故答案为:过滤;
(3)酸性条件下,双氧水能将铜氧化生成铜离子反应的化学方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O;加热条件下,双氧水易分解生成水和氧气,所以除去双氧水的方法是加热,故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O; 加热;
(4)负极发生氧化反应,由方程式可知Zn被氧化生成Zn(OH)2,则电极方程式为Zn+2OH--2e-=Zn(OH)2,故答案为:Zn+2OH--2e-=Zn(OH)2;
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止.其主要反应为2 MnO(OH)+MnO2+2H2C2O4+3H2SO4═3MnSO4+4CO2↑+6H2O.
①该反应中,氧化剂是MnO(OH)、MnO2,还原剂是草酸,当1mol MnO2参加反应时,转移电子的物质的量=$\frac{1mol}{1}$=4mol,故答案为:4;
②MnO(OH)与浓盐酸在加热条件下也可发生反应生成氯化锰、氯气和水,反应方程式为:2MnO(OH)+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2MnCl2+Cl2↑+4H2O,
故答案为:2MnO(OH)+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2MnCl2+Cl2↑+4H2O;
(6)①根据图象知,随着pH的增大,汞的吸收率先先降低后增加,故答案为:先降低后增加;
②酸性条件下,高锰酸钾具有强氧化性,所以酸性条件下的高锰酸钾氧化性更强,故答案为:氧化性.
点评 本题考查了物质的分离和提纯、原电池原理,根据原电池正负极上发生的反应、物质的性质及其分离方法来分析解答,能从整体上把握物质分离过程,熟练掌握基础知识,灵活运用知识解答,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0 mol•L-1 | |
| C. | 该合金中铜与镁的物质的量之比是2:1 | |
| D. | NO2和N2O4的混合气体中,NO2的体积分数是80% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| A | B | C | ||
| (1) | 1 | 3 | 0 | 放出热量a kJ |
| (2) | 0 | 0 | 2 | 吸收热量b kJ |
| (3) | 2 | 6 | 0 | 放出热量c kJ |
| A. | A的体积分数:(2)>(1)>(3) | |
| B. | 三个容器内反应的平衡常数:K(3)=K2(1)=K2(2) | |
| C. | 达平衡时体系压强:P(3)=2P(1) | |
| D. | 热量关系:a+b=50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物理变化、化学变化 | B. | 氧化还原反应、分复反应 | ||
| C. | 氧化还原反应、化合反应 | D. | 分解反应、复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCN水溶液显碱性:CN-+H2O?HCN+OH- | |
| B. | Mg(OH)2固体投人FeCl3溶液中:3Mg(OH)2+2Fe3+=3Mg2++2Fe(OH)3 | |
| C. | Na2S水解:S2-+2H20?H2S+2OH- | |
| D. | H2CO3在水溶液中电离:H2CO3?CO32-+2H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com