
【题目】通过实验得出的结论正确的是
A.某固体试样溶于水,向其中滴加NaOH溶液,没有产生使湿润红色石蕊试纸变蓝的气体,说明原固体中无![]()
B.某固体试样溶于稀盐酸,先滴加KSCN溶液无明显现象,再滴加氯水后显红色,说明原固体中含有![]()
C.某固体试样溶于水得无色溶液,滴加少量新制氯水,再滴加少量![]() ,振荡后静置,下层出现橙红色,说明原固体中含有
,振荡后静置,下层出现橙红色,说明原固体中含有![]()
D.某固体试样溶于稀盐酸,取少量溶液进行焰色反应为黄色,说明原固体为钠盐
【答案】C
【解析】
A.氨气易溶于水,加入氢氧化钠溶液,没有进行加热,因此没有产生使湿润红色石蕊试纸变蓝的气体,固体试样中仍可能存在NH4+,故A错误;
B.某固体试样溶于稀盐酸,先滴加KSCN溶液无明显现象,再滴加氯水后显红色,有Fe3+生成,说明一定含有Fe2+,但原固体不一定含Fe2+,也有可能是铁单质,故B错误;
C.氯水中的氯气和溴离子反应生成溴单质,四氯化碳把溴从水溶液中萃取出来,四氯化碳密度比水大,下层溶液显橙红色,所以滴加少量新制氯水,再滴加少量CCl4,振荡后静置,下层溶液显橙红色说明原溶液中有溴离子,故C正确;
D.焰色反应为元素的性质,只能说明含有钠元素,不一定为钠盐,也可能为NaOH等,故D错误;
故答案选C。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】1100℃时,在体积为5L的密闭容器中,发生可逆反应:Na2SO4(s)+4H2(g)![]() Na2S(s)+4H2O(g)并达到平衡,请完成下列各题:
Na2S(s)+4H2O(g)并达到平衡,请完成下列各题:
(1)上述反应中涉及的非金属元素原子的半径从大到小的顺序为_____________,非金属性最强的元素原子的电子排布式_________________,其电子的自旋方向共有________种。
(2)该反应中O、S属于同主族元素,比较它们的单质的氧化性_____________________(用化学方程式表示),写出Na2O的电子式______,比较Na2O和Na2S的熔点高低:Na2O___Na2S。
(3)上述平衡的平衡常数表达式K=______________________。降低温度,K值减小,则正反应为_______(填“吸热”或“放热”)反应。
(4)能判断反应达到平衡状态的依据是_____________(填序号)。
A.混合气体的压强不变 B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.各气体的浓度相等
(5)若初始时加入的Na2SO4为2.84g,10分钟后达到平衡时Na2SO4的转化率为45%,V(H2)=__________________。平衡后,向容器中充入1molH2,平衡向_________________(填“正反应方向”、“逆反应方向”或“不移动”),重新达到平衡后,与原平衡相比,H2的体积百分含量_____________(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
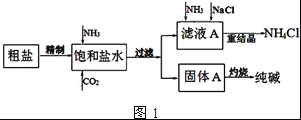
【题目】纯碱(Na2CO3)在生产生活中具有广泛的用途.如图1是实验室模拟制碱原理制取Na2CO3的流程图.
完成下列填空:
已知:粗盐中含有Ca2+、Mg2+、SO42﹣等杂质离子.
(1)精制除杂的步骤顺序是____→___→____→____→____ (填字母编号).
a 粗盐溶解 b 加入盐酸调pH c 加入Ba(OH)2溶液 d 加入Na2CO3溶液 e 过滤
(2)向饱和食盐水中先通入NH3,后通入CO2,理由是______.在滤液a中通入NH3和加入精盐的目的是______.
(3)请在图1流程图中添加两条物料循环的路线.____
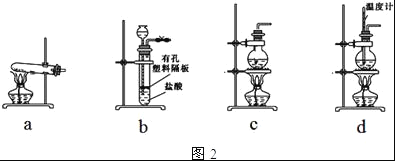
(4)图2装置中常用于实验室制备CO2的是__(填字母编号);用c装置制备NH3,烧瓶内可加入的试剂是___(填试剂名称).
(5)一种天然碱晶体成分是aNa2CO3bNa2SO4cH2O,利用下列提供的试剂,设计测定Na2CO3质量分数的实验方案.请把实验方案补充完整:
供选择的试剂:稀H2SO4、BaCl2溶液、稀氨水、碱石灰、Ba(OH)2溶液
①______.
②______.
③______.
④计算天然碱晶体中含Na2CO3的质量分数.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蒽(![]() )与苯炔(
)与苯炔(![]() )反应生成化合物X(X结构中三个苯环呈立体对称结构),如下图:
)反应生成化合物X(X结构中三个苯环呈立体对称结构),如下图:

(1)蒽与X都属于_________________(填编号)。
a.环烃 b.不饱和烃 c.烷烃 d.芳香烃
(2)苯炔的分子式为_____________,苯炔不具有的性质______________(填编号)。
a.能溶于水 b.能发生氧化反应 c.能发生加成反应 d.常温常压下为气体
(3)X的一个氢原子被甲基取代的所有同分异构体数为__________(填编号)。
a.2种 b.3种 c.4种 d.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.![]() 和CO的混合物共
和CO的混合物共![]() ,其中碳原子的数目为NA
,其中碳原子的数目为NA
B.![]() 重水
重水![]() 分子中含有的中子数为0.8NA
分子中含有的中子数为0.8NA
C.![]() 放入过量的98%浓
放入过量的98%浓![]() 中,转移电子数为3NA
中,转移电子数为3NA
D.![]()
![]() 的NaCl溶液中微粒数大于0.5NA
的NaCl溶液中微粒数大于0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用二氧化锰与浓盐酸反应制备氯气,装置如图1所示,同时证明氯气的某些性质,装置如图2所示。按要求回答下列问题:
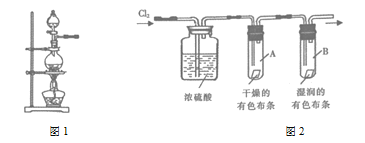
(1)制备实验开始时,先检查装置的气密性。接下来的操作依次是_____(填字母)。
a 往烧瓶中加入![]() 粉末 b 加热 c 分液漏斗中装入浓盐酸,旋开活塞往烧瓶中加入浓盐酸
粉末 b 加热 c 分液漏斗中装入浓盐酸,旋开活塞往烧瓶中加入浓盐酸
(2)写出烧瓶中反应的离子方程式___。
(3)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,甲同学提出:与足量![]() 溶液反应,称量生成的AgCl沉淀质量。方案不可行,原因是_____。
溶液反应,称量生成的AgCl沉淀质量。方案不可行,原因是_____。
(4)图2中,浓硫酸的作用是____;试管A和B中出现的不同现象说明的事实是____。
(5)含氯气的尾气必须吸收处理,装置如图3所示。
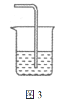
烧杯中的吸收剂可选用___(填序号)。
①饱和食盐水 ②澄清石灰水 ③饱和NaOH溶液
④饱和![]() 溶液 ⑤饱和
溶液 ⑤饱和![]() 溶液
溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号 | I | II | III |
实验 步骤 |
充分振荡,加2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验 现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
下列说法不正确的是( )
A.实验I、II、III中均发生了反应2Fe3++Cu===2Fe2++Cu2+
B.对比实验I、II、III说明白色沉淀的产生可能与铜粉的量及溶液的阴离子种类有关
C.实验II、III中加入蒸馏水后c(Cu2+)相同
D.向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2CO3的电离常数:K1=4.4×10-7,K2=4.7×10-11,HClO的电离常数:2.95×10-8。反应:Cl2+H2O![]() HCl+HClO达到平衡后,要使c(HClO)增大可加入( )
HCl+HClO达到平衡后,要使c(HClO)增大可加入( )
A.NaOHB.HClC.CaCO3(固体)D.H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为周期表中短周期的一部分,若R原子核外有3个未成对电子,说法正确的是

A.原子半径大小顺序是:Y>X>R
B.其气态氢化物的稳定性顺序是:Z>Y>X>R
C.X、Y、Z中Z的氧化物对应的水化物的酸性最强
D.R的气态氢化物与它的含氧酸之间能发生化学反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com