
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下:
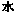

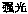


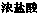 根据要求填空:
根据要求填空: 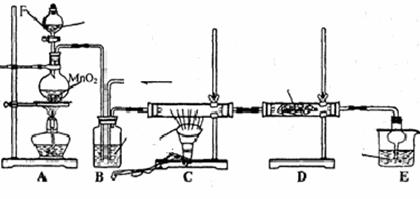
(1)装置A中反应的化学方程式为 。
(2)B装置有三种功能:①控制气流速度;②___ ___;③__ ___________。
(3)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x的取值范围是_____。
(4)E装置的作用是____________(填编号)。
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式_____________________________ 。
(6)装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法为______。该装置还有缺陷,原因是没有进行尾气处理,其尾气的主要成分是_______(填编号)。
A.CH4 B.CH3Cl C.CH2Cl2 D.CHCl3 E.CCl4
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某温度时,把1 mol N2O4气体通入体积为10 L的真空密闭容器中,立即出现红棕色,反应进行4 s时NO2的浓度为0.04 mol·L-1,再经过一定时间后,反应达到平衡,这时容器内压强为开始时的1.8倍。则下列说法正确的是( )
A.前4 s以N2O4的浓度变化表示的平均反应速率为0.01 mol·L-1·s-1
B.4 s时容器内的压强为开始时的1.2倍
C.平衡时容器内含0.4 mol N2O4
D.平衡时容器内含0.8 mol NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
只用一种试剂鉴别正己烷、1-己炔、乙醇、苯酚水溶液4种无色液体,应选用( )
A.酸性KMnO4溶液 B.饱和溴水
C.NaOH溶液 D.AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
某气态化合物X含C、H、O三种元素,现已知下列条件:①X中C的质量分数;②X中H的质量分数;③X在标准状况下的体积;④X对氢气的相对密度;⑤X的质量,欲确定化合物X的分子式,所需的最少条件是 ( )
A.①②④ B.②③④ C.①③⑤ D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验操作设计、现象记录、结论解释都正确的是
| 实验操作设计 | 现象记录 | 结论解释 | |
| A | 将少量浓硝酸逐滴加入Cu 和稀硫酸的混合物中 | 产生红棕色气体 | 硝酸被还原为NO2 |
| B | 用坩埚钳夹住铝箔在酒精灯 上加热 | 铝箔熔化但并不滴落 | 熔点:Al2 O3>Al |
| C | 向某氯化亚铁溶液中加入 Na2O2粉末 | 出现红褐色沉淀 | 加入Na2O2粉末前,原氯化 亚铁溶液已经变质 |
| D | 向紫色石蕊试液中持续长时 间通人氯气 | 溶液先变红,最后变 为无色 | 氯气有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
硅及其化合物在工业上有广泛用途,以硅粉、镁粉等原料制备硅烷的工业流程如下:
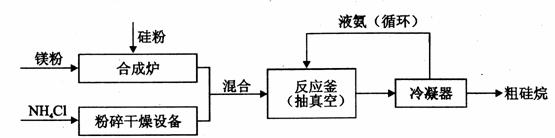
反应釜中发生反应:4NH4 Cl+Mg2 Si 4NH3↑+SiH4↑+2MgCl2 △H<0
4NH3↑+SiH4↑+2MgCl2 △H<0
(1)工业上可用硅烷和氨气生产一种能耐高温的材料Si3 N4,Si3 N4应属于 晶体;NH3、Si3 N4和SiH4三种物质的熔沸点由高到低的顺序是 。
(2)上述生产硅烷的过程中反应釜抽真空的原因是 。
(3)液氨参与循环的作用是 。
(4)氨气也是重要的工业原料,1mol氨气在一定温度下(T>150℃)发生催化氧化反应能释放出226.5kJ的热量,该反应的热化学方程式是 。
(5)三硅酸镁( Mg2Si3O8·nH2O)难溶于水,在医药上可做抗酸剂。它可以中和多余胃酸(主要成分盐酸),生成的难溶物还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与胃酸反应的化学方程式是 。若将1.84g三硅酸镁加到50mL 1.0mol/L盐酸中,充分反应后,滤去沉淀,以甲基橙为指示剂,用l.0mol/L NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30mL,则Mg2Si3O8·nH2O中n的值是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
A.阳极发生还原反应,其电极反应式:Ni2++2e-—→Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
查看答案和解析>>
科目:高中化学 来源: 题型:
在十七大报告中指出:“建设生态文明,基本形成节约能源和保护生态环境的产业结构、增长方式和消费方式……主要污染物排放得到有效控制。”下列做法符合该指导思想的是 ( )。
A.大量使用合成洗涤剂洗涤衣物
B.大量使用尿素替代碳酸氢铵以提高农作物产量
C.大量使用一次性竹、木筷子以推动林业发展
D.大量利用垃圾生产燃料、肥料,“变废为宝”
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com