
将一小块金属钠投入到盛有100ml AlCl3和MgCl2的混合溶液的烧杯中,发现烧杯中有气泡产生,在这过程中还看到烧杯中有白色沉淀产生,沉淀物先多后少。反应完毕后,收集到标准状况下氢气13.44L同时得到21.4g沉淀,将沉淀溶于过量的NaOH溶液中,发现沉淀减少了15.6g,求原混合溶液中Mg2+、Al3+及Cl-的物质的量浓度。
Mg2+:1mol/L Al3+:3mol/L Cl-:11mol/L
【解析】
试题分析:根据2Na+2H2O—→2NaOH+H2↑,n(H2)= =0.6mol;n(Na)= n(NaOH)=1.2mol。
=0.6mol;n(Na)= n(NaOH)=1.2mol。
得到21.4g沉淀,将沉淀溶于过量的NaOH溶液中,发现沉淀减少了15.6g,说明Mg(OH)2是21.4g-15.6g=5.8g,n(Mg2+)=n[Mg(OH)2]=0.1mol,c(Mg2+)=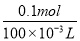 =1mol·L-1。0.1molMg2+需要0.2molNaOH。
=1mol·L-1。0.1molMg2+需要0.2molNaOH。
沉淀减少了15.6g,是Al(OH)3,为0.2mol,由反应Al(OH)3+NaOH—→NaAlO2+2H2O,此时加入0.2mol NaOH。这个实验可视为共加入1.4molNaOH。其中使全部Al3+变为NaAlO2的是1.2mol,由反应:Al3++4OH-—→AlO2-+2H2O可知,n(Al3+)=0.3mol,故c(Al3+)=3mol·L-1。
根据电荷守恒:c(Cl-)=3c(Al3+)+2 c(Mg2+)=11mol·L-1。
考点:化学反应的有关计算。考查Al3+、Mg2+在碱溶液中的反应。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源:2013-2014云南省昭通市毕业生复习统一检测理科综合化学试卷(解析版) 题型:填空题
(15分)X、Y、Z、W、R、T为前四周期元素且原子序数依次增大。T原子序数等于X、Y、R原子序数之和。Z为地壳中含量最多的元素。X、Z原子核外均有2个未成对电子。Z与R位于同一主族。X、Y、Z、W、R、T中只有两种金属元素,且存在下列反应: 2W+XZ2  X+2WZ
X+2WZ
回答下列问题:
(1)X、Y、Z的第一电离能最大的是 (用元素符号表示)。
(2)在元素R和元素Z形成的常见化合物中,属于非极性分子的是 (填化学式),该分子中中心原子以 杂化。
(3)由X、T元素组成的单质中一定不存在 (填序号)。
A、离子晶体 B、分子晶体 C、原子晶体 D、金属晶体
(4)基态T原子的核外电子排布式为 。
(5)T+能与NH3通过配位键结合为[T(NH3)n]+。该离子中T+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子对。① [T(NH3)n]+中n= 。② [T(NH3)n]+中T+与n个氮原子构成的空间结构呈 型。
(6)化合物WZ和NaCl的晶胞结构形似
(氯化钠晶胞结构如右图所示)。
①在WZ中,阳离子和阴离子的配位数均为 。
②已知WZ的密度为a g/cm3,则WZ中距离最近的阳离子间的距离为 pm(用含a的算式表示,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源:2013-2014上海市静安区第二学期高二学业水平测试化学试卷(解析版) 题型:计算题
某金属M的氢氧化物的水合晶体[M(OH)2?xH2O]与Na2CO3混合物共36.800g,加入足量的水后,生成MCO3的白色沉淀,将沉淀滤出,洗净烘干,其质量为9.850g。
47. 将 9.850g MCO3高温灼热至恒重,得到7.650g MO固体,则产生CO2气体_______mol。
48.滤液与酸作用不产生气体;若用足量的铵盐与滤液共热,则产生4.48L气体(标准状况),滤液中OH‑的物质的量为_______mol。
49.M的相对原子质量为_________;试通过计算确定M(OH)2?xH2O中x的值:
查看答案和解析>>
科目:高中化学 来源:2013-2014上海市静安区第二学期高二学业水平测试化学试卷(解析版) 题型:选择题
能用离子方程式Ba2++SO42- →BaSO4↓表示的是
A.氯化钡和硫酸钠溶液反应 B. 碳酸钡和稀硫酸反应
C.氢氧化钡和硫酸铝溶液反应 D. 氢氧化钡和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源:2013-2014上海市静安区第二学期高二学业水平测试化学试卷(解析版) 题型:选择题
相对原子质量原来以16O原子质量的十六分之一为标准,以该标准得到的仍为整数的是
A.14N的质量数 B.碳原子的相对质量
C.氯元素的相对原子质量 D.氢氧化钠的摩尔质量
查看答案和解析>>
科目:高中化学 来源:2013-2014上海市宝山区高二年级化学学科质量监测化学试卷(解析版) 题型:填空题
金属是一种重要的材料,人类的生产和生活离不开金属,下表表示了金属活动顺序表中铜、铁、锡、铝元素被人类大规模开发利用的大致年代。

33. 根据图中数据和有关化学知识,你认为金属大规模开发利用的先后顺序跟______有关(填写编号)。
a. 金属的导热性 b. 金属元素在地壳中的含量
c. 金属的活动性顺序 d. 金属的延展性
34. 钢铁的生产和使用是人类文明和进步的重要标志之一,请用化学方程式表示高炉炼铁的原理___________________________________________。
35. 比较铝、铁的活泼性,可用一个实验事实说明:__________________________________;
但是铝在空气中却表现出很强的抗氧化性,其原因是____________________________。
36. 复方氢氧化铝可以治疗胃酸过多,也能与强碱溶液反应, 写出氢氧化铝的电离方程式___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014上海市宝山区高二年级化学学科质量监测化学试卷(解析版) 题型:选择题
某无色溶液含有Na+、Fe3+、Cl-、SO42-中的2种离子,分别取该溶液进行了下列实验:
(1)向溶液中滴加用硝酸酸化的AgNO3溶液,有白色沉淀产生;
(2)向溶液中滴加Ba(NO3)2溶液,没有任何现象。
根据上述实验,可以确定溶液中一定存在的离子是
A.Fe3+和Cl- B. Na+和SO42- C. Fe3+ 和SO42- D. Na+和Cl-
查看答案和解析>>
科目:高中化学 来源:2013-20147山东省乳山市下学期期中考试高二化学试卷(解析版) 题型:简答题
(11分)某芳香族化合物H常用作防腐剂,H可利用下列路线合成:
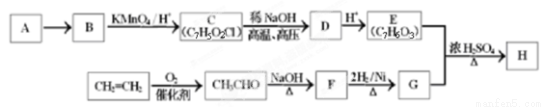
已知:①A是相对分子质量为92的烃;

④ D的核磁共振氢谱表明其有两种不同化学环境的氢(两种不同位置的氢原子),且峰面积之比为1:1。
回答下列问题:
(1)A的分子式为___________,由A→B的反应试剂和反应条件为____________。
(2)写出C→D的反应方程式:_________________________________________。
(3)同时符合下列条件的E的同分异构体共有____________种。
①分子中含有苯环 ②能发生银镜反应  ③能与FeCl3溶液发生显色反应。
③能与FeCl3溶液发生显色反应。
(4)检验F中含氧官能团的试剂为____________(填试剂名称),由F→G的反应类型为______ 。
(5)H的结构简式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(海南卷解析版) 题型:填空题
(9分)
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液;
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
己知:Ksp[Fe(OH)3]= 4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为 :
(2)过程I 加入铁屑的主要作用是 ,分离得到固体的主要成分是 ,从固体中分离出铜需采用的方法是 ;
(3)过程II中发生反应的化学方程式为 ;
(4)过程II中调节溶液的pH为5,金属离子浓度为 。(列式计算)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com