
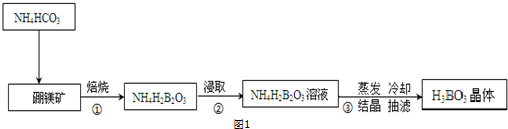
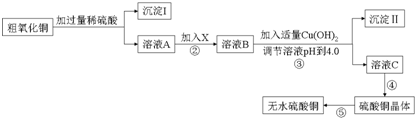
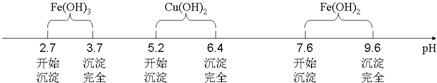
分析 根据工业流程,硼镁矿主要成分为Mg2B2O5.H2O中加入碳酸氢铵进行灼烧可得NH4H2BO3固体,将灼烧后的固体用水溶解再过滤得NH4H2BO3溶液,对NH4H2BO3溶液进行蒸发浓缩、冷却结晶,再抽滤可得硼酸晶体,
(1)灼烧固体应在坩埚中进行;
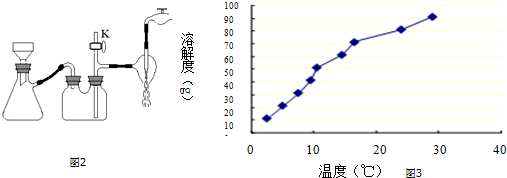
(2)根据装置图可知,若实验过程中发现倒吸现象,应采取的措施是打开旋塞K;从NH4H2BO3溶液获得硼酸晶体蒸发浓缩、冷去结晶、过滤、洗涤、干燥获得硼酸晶体,根据沉淀溶解平衡的影响因素可知,用较稀的NH4H2BO3溶液能促使NH4H2BO3晶体析出,而形成大晶体;
(3)硼酸与水作用,B(OH)3+H20?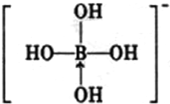 +H+,导致溶液呈酸性;硼酸溶解度如下所示,从NH4H2BO3溶液获得硼酸晶体蒸发浓缩、冷去结晶、过滤、洗涤、干燥获得硼酸晶体,由溶解度曲线可知,硼酸溶解度随着温度升高增大较快,所以用冷水洗涤能减少硼酸溶解损失;
+H+,导致溶液呈酸性;硼酸溶解度如下所示,从NH4H2BO3溶液获得硼酸晶体蒸发浓缩、冷去结晶、过滤、洗涤、干燥获得硼酸晶体,由溶解度曲线可知,硼酸溶解度随着温度升高增大较快,所以用冷水洗涤能减少硼酸溶解损失;
(4)根据题目信息:每1.00mlNaOH滴定液相当于30.92mg的H3BO3计算出样品中H3BO3的质量,然后求出质量分数
解答 解:(1)灼烧固体应在坩埚中进行,
故答案为:坩埚;
(2)根据装置图可知,若实验过程中发现倒吸现象,应采取的措施是打开旋塞K,从NH4H2BO3溶液获得硼酸晶体蒸发浓缩、冷去结晶、过滤、洗涤、干燥获得硼酸晶体,根据沉淀溶解平衡的影响因素可知,用较稀的NH4H2BO3溶液能促使NH4H2BO3晶体析出,而形成大晶体,故选C,
故答案为:打开旋塞K;C;
(3)硼酸与水作用,B(OH)3+H20? +H+,导致溶液呈酸性;硼酸溶解度如下所示,从NH4H2BO3溶液获得硼酸晶体蒸发浓缩、冷去结晶、过滤、洗涤、干燥获得硼酸晶体,由溶解度曲线可知,硼酸溶解度随着温度升高增大较快,所以用冷水洗涤能减少硼酸溶解损失,
+H+,导致溶液呈酸性;硼酸溶解度如下所示,从NH4H2BO3溶液获得硼酸晶体蒸发浓缩、冷去结晶、过滤、洗涤、干燥获得硼酸晶体,由溶解度曲线可知,硼酸溶解度随着温度升高增大较快,所以用冷水洗涤能减少硼酸溶解损失,
故答案为:B(OH)3+H2O?B(OH)4-+H+;冷水;硼酸溶解度随着温度升高增大较快,用冷水洗涤能减少硼酸溶解损失;
(4)每1.00mlNaOH滴定液相当于30.92mg的H3BO3,用NaOH标准溶液滴定至15.80ml时,溶液恰好显粉红色且半分钟不褪色,则相当于30.92mg×15.8=488.536mg=0.488536gH3BO3,所以测该样品中H3BO3的质量分数为 $\frac{0.488536g}{0.5000g}$×100%=97.71%;
故答案为:97.71%.
点评 本题考查了物质制备的流程分析判断,物质性质和实验过程判断,滴定实验的操作过程和计算应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题

| A. | 它的一氯代物只有一种同分异构体 | |
| B. | 它的二氯代物有两种同分异构体 | |
| C. | 它的分子式为C8H8 | |
| D. | 它与苯乙烯(C6H5-CH=CH2)互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,平衡时若充入稀有气体,SO2的转化率增大 | |
| B. | 0~6 min的平衡反应速率:v(O2)=0.105 mol/(L•min) | |
| C. | 保持其他条件不变,仅降低温度,正反应速率减小程度比逆反应速率减小程度大 | |
| D. | 反应开始时,向容器中通入的SO2的物质的量是1.4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 溴乙烷是有机合成的重要原料,实验室合成溴乙烷的装置示意图、相关原理和数据如下:
溴乙烷是有机合成的重要原料,实验室合成溴乙烷的装置示意图、相关原理和数据如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解度 | |
| 乙醇 | 46 | 0.789 | 78.3 | 易溶 |
| 溴乙烷 | 109 | 1.46 | 38.2 | 难溶 |
| 浓硫酸(H2SO4) | 98 | 1.84 | 338.0 | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 第一次 | 第二次 | 第三次 |
| 滴定前读数(mL) | 0.10 | 0.36 | 1.10 |
| 滴定滴定后读数(mL) | 20.12 | 20.34 | 22.12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
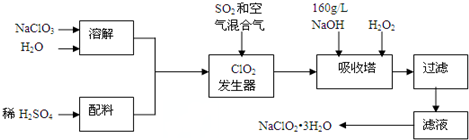
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
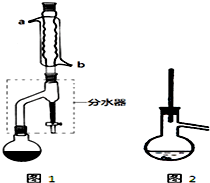 有机物的反应往往伴随副反应发生,因此 需要分离提纯.有一种水果香精的合成步骤如下:
有机物的反应往往伴随副反应发生,因此 需要分离提纯.有一种水果香精的合成步骤如下:| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度/(g/mL) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点/℃ | 117.8 | 118.1 | 126.1 | 143 |
| 在水中的溶解性 | 易溶 | 易溶 | 难溶 | 难溶 |
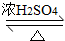 CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2O4(g)═2NO2(g),改变某一条件后,气体颜色加深 | |
| B. | H2(g)+I2(g)═2HI(g),单位时间内消耗H2和HI的物质的量之比大于1:2 | |
| C. | N2(g)+3H2(g)═2NH3(g),改变某一条件后,NH3的体积分数增加 | |
| D. | 2SO2(g)+O2(g)═2SO3(g),恒温恒压条件下,充入He |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K1=K2 | B. | K1<K2 | C. | K1>K2 | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com