
| 步骤 | 现象 |
| ⅰ.向盛有30mL 0.2mol?L-1KI溶液的锥形瓶中依次滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 | 随着KBrO3溶液滴入,溶液由无色变为蓝色并逐渐加深 |
| ⅱ.继续向上述溶液中滴入KBrO3溶液 | 溶液的蓝色逐渐褪去 |


科目:高中化学 来源: 题型:
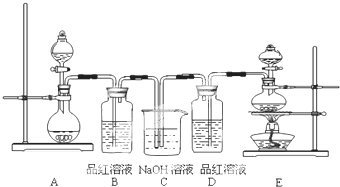
查看答案和解析>>
科目:高中化学 来源: 题型:
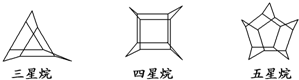
| A、它们之间互为同系物 |
| B、三星烷的化学式为C9H12 |
| C、三星烷与丙苯互为同分异构体 |
| D、它们的一氯代物均只有两种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 客观事实 | 理论解释 |
| A | Na+比Na原子稳定 | Na+最外电子层电子数有8个而Na只有1个 |
| B | 熔化状态下NaCl能导电而NaCl晶体不能导电 | 熔化状态下的NaCl中存在离子而NaCl晶体中没有离子 |
| C | 同温同压同物质的量的气体体积相等 | 相同条件下气体的分子间平均距离相等 |
| D | 钠投入水中熔成小球 | 该反应为放热反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
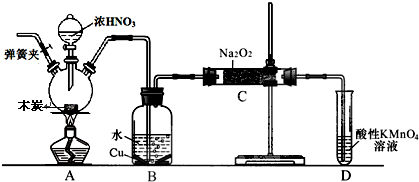
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.02mol?L-1 |
| B、0.05mol?L-1 |
| C、0.25mol?L-1 |
| D、0.5mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若5.6 LN2中含有N个氮分子,则阿伏加德罗常数为4N |
| B、1mol?L-1NaCl溶液含有NA个Na+离子 |
| C、14 g CO气体中所含的分子数为0.5NA |
| D、标准状况下,22.4 L CCl4含有的分子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子个数比为17:16 |
| B、原子个数比为16:17 |
| C、氢原子个数比为17:12 |
| D、相同状况下密度比为17:16 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com