
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。电解一段时间后,若在电解池中C极一侧出来的气体无色无味,D极一侧出来的气体呈黄绿色有刺激性气味。请回答以下问题:
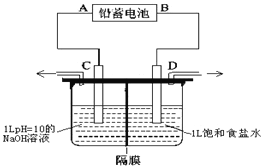
(1)已知铅蓄电池在放电时发生的反应:Pb+PbO2+4H++2SO42-=2PbSO4+2H2O,则A极为电源的_________极(填“正”或“负”),电极反应为___________________________;
(2)电解饱和食盐水的离子反应方程式是__________________;
(3)电极C的电极反应是_____________________________________________;
(4)电解时为防止两种气体产物混合,用阳离子交换膜做隔膜。则电解时Na+从______极区移向_____极区(填“C”或“D”);
(5)若电路上有0.2mol电子的电量通过,则铅蓄电池中消耗硫酸_________mol。
【答案】负Pb+2e-+SO42-=PbSO42Cl-+2H2O![]() 2OH-+H2↑+Cl2↑2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑DC0.2
2OH-+H2↑+Cl2↑2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑DC0.2
【解析】
电解一段时间后,若在电解池中C极一侧出来的气体无色无味是氢气,则C极是阴极,D极一侧出来的气体呈黄绿色有刺激性气味是氯气,D极是阳极,所以原电池中A极是负极,B极是正极,据此解答。
根据以上分析可知A极是负极,B极是正极,C极是阴极,D极是阳极,则
(1)A是负极,负极上铅失电子和硫酸根离子结合生成硫酸铅,则负极电极反应为Pb+2e-+SO42-=PbSO4;
(2)电解氯化钠溶液时,C是阴极,阴极上得电子发生还原反应,电极反应式为2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑,D是阳极,阳极上氯离子失电子发生氧化反应,电极反应式为2Cl--2e-=Cl2↑,同时生成氢氧化钠,所以其电池反应式为2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;
2OH-+H2↑+Cl2↑;
(3)根据以上分析可知电极C的电极反应为2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑;
(4)氯碱工业中所用的高分子隔膜叫做阳离子膜,其作用是让阳离子钠离子穿过,阻止氯离子和氢氧根离子穿过,防止氯气和氢气接触而发生反应,同时防止氯气和氢氧化钠接触发生反应。电解池中阳离子向阴极移动,因此电解时Na+从D极区移向C极区;
(5)根据方程式Pb+PbO2+4H++2SO42-=2PbSO4+2H2O可知当转移2mol电子时,消耗硫酸的物质的量是2mol,则转移0.2mol电子时消耗硫酸的物质的量是0.2mol。


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)100°C时,KW=1.0×10﹣12,在该温度下,测得0.1mol/LNa2A溶液pH=6.
①H2A在水溶液中的电离方程式为_____;
②体积相等pH=1的盐酸与H2A溶液分别与足量的Zn反应,与盐酸相比,H2A溶液产生的H2____(填“多”、“少”或“一样多”).
(2)将0.4 mol/L HB溶液与0.2 mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液中c(Na+)>c(B-)。
①混合溶液中c(B﹣)_____c(HB)(填“>”、“<” 或“=”);
②混合溶液中c(HB)+ c(B-)_____0.2mol/L(填“>”、“<”或“=”).
(3)已知在常温下常见弱酸的电离平衡常数Ka如表所示:
溶质 | CH3COOH | H2CO3 | HClO | HCN |
电离平衡常数Ka | 1.75×10-5 | Ka1=4.4×10-7 Ka2=4.7×10-11 | 3.2×10-8 | 6.2×10-10 |
①少量二氧化碳通入NaClO溶液中的离子方程式_____;
②浓度均为0.01mol/L的下列4种物质的溶液分别加水稀释100倍,pH变化最小的是_____(填编号);
a.CH3COOH b.HCN c.HClO d.H2CO3
③常温下浓度相同的醋酸和醋酸钠混合液pH=6,则c( CH3COO-)﹣c( CH3COOH)=___mol/L(用数值列出计算式即可).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题:
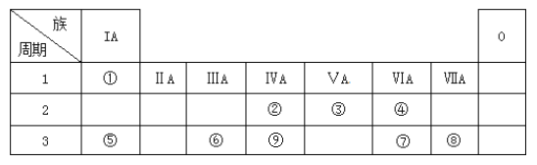
(1)第三周期中元素非金属性最强的元素的原子结构示意图为__________。
(2)②③⑨最高价氧化物对应水化物酸性强弱顺序为(填化学式)_____________。
(3)用电子式表示④的氢化物的形成过程_________________________。
(4)下列可以判断⑤和⑥金属性强弱的是__________。
a. ⑤单质的熔点比⑥单质低
b. ⑤的化合价比⑥低
c. ⑤单质与水反应比单质⑥剧烈
d. ⑤最高价氧化物的水化物的碱性比⑥强
(5)由表中①、③、④、⑥、⑧元素形成的常见物质Z、M、N可发生以下反应:
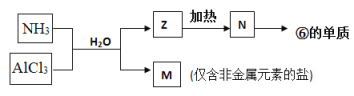
a. M中所含的化学键种类为(若含共价键,请标明极性或非极性)_________。
b. N→⑥的单质的化学方程式_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
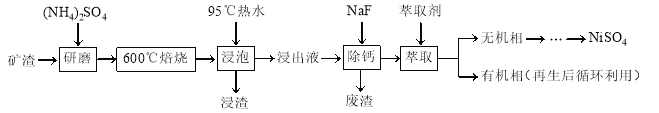
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是______________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为______________,“浸渣”的成分除Fe2O3、FeO(OH)外还含有______________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的________倍;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为______________。
(4)“浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-) = ________ mol·L-1。[已知Ksp (CaF2)=4.0×10-11]
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值是________。
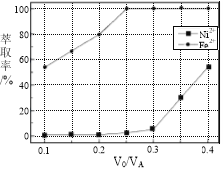
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的恒容密闭容器中充入6molCO2 和8molH2,发生反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H= -49.0kJmol-1,测得n(H2)随时间的变化如曲线Ⅰ所示。下列说法正确的是
CH3OH(g)+H2O(g) △H= -49.0kJmol-1,测得n(H2)随时间的变化如曲线Ⅰ所示。下列说法正确的是
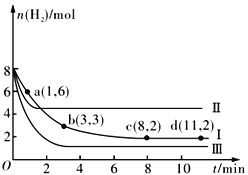
A. 该反应在0~8 min内CO2 的平均反应速率是0.375mol·L-1·min-1
B. 保持温度不变,若起始时向上述容器中充入4molCO2、2molH2、2molCH3OH(g)和1mol H2O(g),则此时反应向正反应方向进行
C. 保持温度不变,若起始时向上述容器中充入3molCO2 和4molH2,则平衡时H2 的体积分数等于20%
D. 改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 电解法,反应为2Cu + H2O |
方法c | 用肼(N2H4)还原新制Cu(OH)2 |
(1)已知:2Cu(s)+![]() O2(g)=Cu2O(s)△H =-169kJ·mol-1
O2(g)=Cu2O(s)△H =-169kJ·mol-1
C(s)+![]() O2(g)=CO(g)△H =-110.5kJ·mol-1
O2(g)=CO(g)△H =-110.5kJ·mol-1
Cu(s)+![]() O2(g)=CuO(s)△H =-157kJ·mol-1
O2(g)=CuO(s)△H =-157kJ·mol-1
则方法a发生反应的热化学方程式是_____________________________________。
(2)方法b采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该离子交换膜为______离子交换膜(填“阴”或“阳”),该电池的阳极反应式为______________________________________。

(3)方法c为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为________________________________________。
(4)在容积为1L的恒容密闭容器中,用以上方法制得的三种纳米级Cu2O分别进行催化分解水的实验:2H2O(g) ![]() 2H2(g)+O2(g),ΔH>0。水蒸气的浓度c随时间t的变化如下表所示。
2H2(g)+O2(g),ΔH>0。水蒸气的浓度c随时间t的变化如下表所示。

①对比实验的温度:T2_________T1(填“>”、“<”或“=”)
②催化剂催化效率:实验①________实验②(填“>”或“<”)
③在实验③达到平衡状态后,向该容器中通入水蒸气与氢气各0.1mol,则反应再次达到平衡时,容器中氧气的浓度为 ____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~J是中学化学常见的物质,它们之间的转化关系如下图所示 (部分反应条件、生成物已省略)。已知A是一种高熔点物质,D是一种红棕色固体。
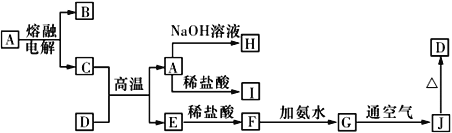
请回答下列问题:
(1)电解A物质的阴极电极反应式为________,C与D在高温下反应,引发该反应需要加入的两种试剂是________________________(填名称)。
(2)写出G→J反应的实验现象与化学方程式:____________________________,________________________________。
(3)C与NaOH溶液反应的离子方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物在氧气中充分燃烧,生成等物质的量的水和二氧化碳,则该有机物必须满足的条件是( )
A. 分子中的C、H、O的个数比为1:2:3B. 分子中C、H个数比为1:2
C. 该有机物的相对分子质量为14D. 该分子中肯定不含氧元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com