
���� ��1��A�����ݷ�Ӧ���жϷ�Ӧ�����������������Դ�С��
B�����ݷ�Ӧ���ж����������ͷų���������Դ�С��
C��CH3OH������ȼ����Ϊ����192.9kJ•mol-1��
D��Һ̬�ų��������٣�
��2��2.2kg CO2�����ʵ�����$\frac{2200g}{44g/mol}$�����ݶ�����̼�����ʵ����뷴Ӧ��֮��Ĺ�ϵд���Ȼ�ѧ��Ӧ����ʽ��
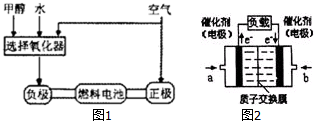
��3�����ݵ�������֪��a���缫�Ǹ�����b���缫��������������ȼ��ʧ���ӷ���������Ӧ���������������õ��ӷ�����ԭ��Ӧ��
��� �⣺��1��A���÷�Ӧ�����ȷ�Ӧ�������������������ڷ�Ӧ���������ʴ���
B���÷�Ӧ�����ȷ�Ӧ�����Զϼ����յ��������ڳɼ��ų�������������ȷ��
C��CH3OH������ȼ����Ϊ����192.9kJ•mol-1������ȷ��
D��Һ̬�ų��������٣�����ȷ��
��ѡBCD��
��2��2.2kg CO2�����ʵ�����$\frac{2200g}{44g/mol}$��50mol������̼�μӷ�Ӧ�ų�2473.5kJ����������1mol������̼�μӷ�Ӧ�ų���������49.47kJ�����Ը÷�Ӧ�Ȼ�ѧ��Ӧ����ʽΪ��CO2��g��+3H2��g��=H2O��g��+CH3OH��g����H=-49.47kJ/mol��
�ʴ�Ϊ��CO2��g��+3H2��g��=H2O��g��+CH3OH��g����H=-49.47kJ/mol��
��3�����ݵ�������֪��a���缫�Ǹ�����b���缫��������������Ͷ��������������b��ͨ��������������������������Ͷ��ȼ�ϼ״����״�ʧ���Ӻ�ˮ��Ӧ���ɶ�����̼�������ӣ��缫��ӦʽΪ��CH3OH+H2O-6e-=CO2+6H+��
�ʴ�Ϊ�������������CH3OH+H2O-6e-=CO2+6H+��
���� ���⿼�����Ȼ�ѧ��Ӧ����ʽ����д��ԭ���ԭ�����ѶȲ���ע��ȼ�ϵ���е缫��Ӧʽ����дҪ��ϵ������Һ������ԣ�Ϊ�״��㣮


 �ƸԿ�����ҵ��ϵ�д�
�ƸԿ�����ҵ��ϵ�д� ��Ԫ����ĩ��ϰ�ȷ��ϵ�д�
��Ԫ����ĩ��ϰ�ȷ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �� | ����ƽ�ⳣ��K |
| CH3COOH | 1.76��10-5 |
| H2CO3 | K1=4.3��10-7 K2=5.61��10-11 |
| H3PO4 | K1=7.52��10-3 K2=6.23��10-8 K3=2.20��10-13 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Mg2+��Fe3+��Cl-��H+ | B�� | Fe2+��SO42-��CO32-��NO3- | ||
| C�� | Ba2+��NO3-��Cl-��Na+ | D�� | K+��NH4+��SO42-��HCO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na2O2���ڼ��������� | |
| B�� | ������pHС��7����ˮ | |
| C�� | CO2��NO2��SO2���ᵼ��������γ� | |
| D�� | ������һ�ֽ��壬�ܷ��������ЧӦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ����ˮ�ķ�Ӧ��2Na+2H2O�T2Na++2OH-+H2�� | |
| B�� | ��������Һ��ͨ�����CO2��SiO32-+2CO2+2H2O�TH2SiO3��+2HCO3- | |
| C�� | ������ˮ��Ӧ��Cl2+H2O�T2H++Cl-+ClO- | |
| D�� | ������Һ�м��������Ba��OH��2��Һ��Al3++4OH-�TAlO2-+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������֡���ͭ�����ںϽ� | |
| B�� | 14C��������������ļ�����14C��12C��Ϊͬ�������� | |
| C�� | ʳ�ס����ʳ�ηֱ������ᡢ��� | |
| D�� | ���ࡢ��֬�͵����ʶ�����Ȼ�߷��ӻ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ҵ� | B�� | �������� | C�� | ����ǦŨ��Һ | D�� | ��NH4��2S04Ũ��Һ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com