
【题目】下列家庭小实验中不涉及化学变化的是( )
A.用熟苹果催熟青香蕉 B.用少量食醋除去水壶中的水垢
C.用糯米、酒曲和水制成甜酒酿 D.用木炭除去冰箱中的异味
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有MgCl2和Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的体积关系如图所示,则原溶液中MgCl2和Al2(SO4)3的物质的量浓度之比为( )

A. 1:2 B. 2:1 C. 1:1 D. 2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO、SiO2等)制备绿矾(FeSO4·7H2O)的流程如下:
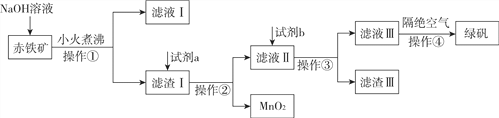
(1)滤液Ⅰ中所含的阴离子有________。
(2)试剂a为________,试剂b投入到滤液Ⅱ发生的所有反应的化学方程式为________。
(3)实验室中操作①所需的玻璃仪器有________。
(4)操作④的名称为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物合成、应用及氮的固定一直是科学研究的热点。
(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);ΔH=akJ/mol
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98kJ/mol
则a为_____________。
(2)反应2NH3(g)+CO2(g) ![]() CO(NH2)2(l)+H2O(g)在合成塔中进行。下图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比[n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。
CO(NH2)2(l)+H2O(g)在合成塔中进行。下图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比[n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。
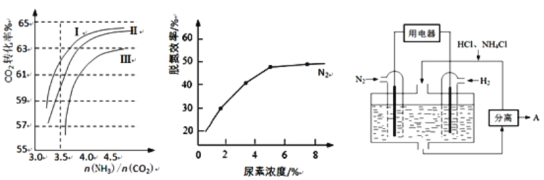
图1 图2 图3
①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值分别为:
A.0.6~0.7 B.1~1.1 C.1.5~1.61
生产中应选用水碳比的数值为_____________(选填序号)。
②生产中氨碳比宜控制在4.0左右,而不是4.5的原因可能是_____________。
(3)尿素可用于湿法烟气脱氮工艺,其反应原理为:
NO+NO2+H2O=2HNO2
2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)=________(空气中氧气的体积含量大约为20%)。
②图2是尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为________%。
(4)图3表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式_____________。生产中可分离出的物质A的化学式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备单质硅时,主要化学反应如下:①SiO2+2C=Si+2CO↑;②Si+2Cl2=SiCl4;③SiCl4+2H2=Si+4HCl。下列对上述三个反应的叙述中,不正确的是( )
A.①③为置换反应
B.①②③均为氧化还原反应
C.②为化合反应
D.三个反应的反应物中硅元素均被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.控制塑料购物袋的使用主要是为了节约成本
B.使用可降解塑料袋有利于减少“白色污染”
C.聚氯乙烯塑料袋可用来长时间存放食品
D.塑料购物袋具有热固性,不能回收利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.理论上任何氧化还原反应都可以设计成原电池。
B.甲烷的标准燃烧热为890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ/mol
C.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g)△H=-38.6 kJ/mol
2NH3(g)△H=-38.6 kJ/mol
D.同温同压下,等量的氢气完全发生反应:H2(g)+Cl2(g)=2HCl(g),在点燃条件下放出的热量与光照条件下放出的热量相等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮广泛地分布在自然界中,碳、氮的化合物性能优良,在工业生产和科技领域有重要用途。
(1)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300~1700°C的氮气流中反应制得:3SiO2(s) + 6C(s) + 2N2(g)![]() Si3N4(s) + 6CO(g) △H=-1591.2 kJ·mol-1,则该反应每转移1mol e-,可放出的热量为 。
Si3N4(s) + 6CO(g) △H=-1591.2 kJ·mol-1,则该反应每转移1mol e-,可放出的热量为 。
(2)某研究小组现将三组CO(g) 与H2O(g) 的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g),得到下表数据:
CO2(g) + H2(g),得到下表数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
CO | H2O | CO | H2 | |||
1 | 650 | 2 | 4 | 0.5 | 1.5 | 5 |
2 | 900 | 1 | 2 | 0.5 | 0.5 | |
① 实验1中,前5min的反应速率v(CO2) = 。
② 下列能判断实验2已经达到平衡状态的是 (填序号)。
a.容器内CO、H2O、CO2、H2的浓度不再变化
b.容器内压强不再变化
c.混合气体的密度保持不变
d.v正(CO)=v逆(CO2)
e.容器中气体的平均相对分子质量不随时间而变化
③ 若实验2的容器是绝热的密闭容器,实验测得H2O(g) 的转化率ω(H2O)随时间变化的示意图如图1所示,b点v正 v逆(填“<”、“=”或 “>”),t3~t4时刻,H2O(g) 的转化率ω(H2O)降低的原因是 。

(3)利用CO与H2可直接合成甲醇,上图是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图如图2,写出以石墨为电极的电池工作时负极的电极反应式 ,利用该电池电解1L 0.5mol·L-1的CuSO4溶液,当电池消耗560mLO2(标准状况下)时,电解后溶液的pH= (溶液电解前后体积的变化忽略不计)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com