
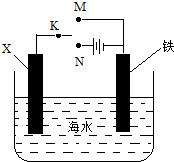
| A. | 若X为碳棒,为减缓铁的腐蚀,开关K应置于N处 | |
| B. | 若X为碳棒,开关K置于M处,会加快铁的腐蚀 | |
| C. | 若X为锌,开关K置于M处,就是牺牲阳极的阴极保护法 | |
| D. | 若X为锌,开关K置于N处,铁电极发生的反应为Fe-2e-═Fe${\;}_{3}^{-}$ |
分析 根据金属的防护,若K置于N处,必须让被保护的金属接电源负极;若开关K置于M处,形成原电池,若要使金属铁被保护,需让铁做正极,据此分析.
解答 解:A、若X为碳棒,当开关K置于N处时,形成电解池,铁做阴极被保护,能减缓铁的腐蚀,故A正确;
B、当X为碳棒,开关K置于M处时,形成原电池,铁做负极,会加快铁的腐蚀,故B正确;
C、当X为锌时,开关K置于N处,形成原电池,铁做原电池的正极被保护,即为牺牲阳极的阴极保护法,故C正确;
D、当X为锌时,开关K置于N处,形成电解池,铁做阴极,故阴极上的电极反应为:O2+4e-+2H2O=4OH-,故D错误.
故选D.
点评 本题考查学生原电池和电解池的工作原理以及金属的腐蚀和防护知识,注意知识的梳理和归纳是解题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 2Fe3++Fe═3Fe2+成立,说明氧化性:Fe3+>Fe2+ | |
| B. | SO2饱和溶液中NH4+、K+、CO32-、SO32-可大量存在 | |
| C. | 用NaOH溶液吸收尾气中的氯气:Cl2+4OH-═2ClO-+2H2O | |
| D. | 向NaHS溶液中加入适量硝酸发生反应:HS-+H+═H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ag+、NO3-、Br- | B. | Cu2+、SO42-、Cl-、H+ | ||
| C. | Na+、Mg2+、SO42-、Cl- | D. | Ca2+、K+、OH-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{{K}_{W}}{c({H}^{+})}$=0.1molgL-1的溶液:Na+、K+、SiO32-、NO3- | |
| B. | 加苯酚显紫色的溶液:K+、NH4+、Cl-、I- | |
| C. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- | |
| D. | 通足量SO2后的溶液:Na+、NH4+、ClO-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 我国部分城市灰霾天占全年一半.引起灰霾的PM2.5微细粒子包含(NH4)2S04、NH4N03、有机颗粒物及扬尘等.通过测定灰霾中锌等重金属的含量,可知交通污染是目前造成我国灰霾天气主要原因之一.
我国部分城市灰霾天占全年一半.引起灰霾的PM2.5微细粒子包含(NH4)2S04、NH4N03、有机颗粒物及扬尘等.通过测定灰霾中锌等重金属的含量,可知交通污染是目前造成我国灰霾天气主要原因之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1=-57.3kJ/mol是强酸和强碱在稀溶液中反应生成可溶性盐的中和热 | |
| B. | 在氢氧化钠溶液与盐酸的反应中,盐酸量一定,氢氧化钠溶液量越多,中和热越大 | |
| C. | HF的电离方程式及热效应:HF(aq)?H+(aq)+F-(aq)△H>0 | |
| D. | 稀硫酸与稀氢氧化钡溶液反应的热化学方程式为H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)△H=-114.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若甲为焦炭,则丁可能是O2 | B. | 若甲为SO2,则丁可能是氨水 | ||
| C. | 若甲为Fe,则丁可能是氯气 | D. | 若甲为NaOH溶液,则丁可能是CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
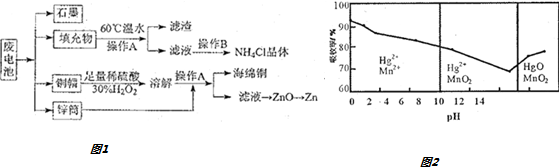
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和滴定时盛待测的锥形瓶中有少量水对滴定结果无影响 | |
| B. | 在酸碱中和滴定实验中,滴定管都需要润洗,否则引起误差 | |
| C. | 滴定时,左手控制滴定管的活塞,右手握持锥形瓶,边滴加振荡,眼睛注视滴定管中的液面 | |
| D. | 在酸碱中和滴定实验中,滴定前仰视滴定后俯视会引起误差 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com