
分析 (1)依据题干信息“类金刚石氮化物”,通过硅类推AlN的晶体类型为原子晶体;根据物质不一定完全反应进行判断;
(2)①由题目信息可知,由于AlN跟氢氧化钠溶液反应生成NaAlO2、并放出NH3,据此得到方程式.
生成0.15molNH3,根据氮元素守恒可知10.00g样品中含有AlN的物质的量为0.15mol,根据m=nM计算AlN的质量,再根据质量分数定义计算;
②反应产物可能CO2、CO或CO2和CO、CO2和O2的混合气体,根据气体产物的密度可计算出气体产物的平均相对分子质量为30,所以生成气体必定是CO2和CO混合气体.设混合气体中含有CO2xmol,CO ymol,根据氧原子守恒和平均相对分子质量的计算,列放出计算x、y的值,样品中n(C)=(x+y)mol,据此计算样品中碳的质量;
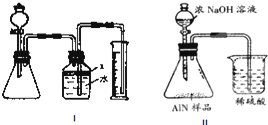
(3)制取气体时,为防止装置漏气应在连接装置后立即进行装置气密性检查,确定装置不漏气后,本着先加固体后加液体的原则加入药品;最后进行气体的收集与测量;
①产生的氨气极易溶于水,为防止氨气溶于水需要把气体与水隔离,因此应选择不能与氨气产生作用的液体作为隔离液;选用的试剂应是和水不互溶,且密度大于水的;②计算出氨气的体积为aL的物质的量,再根据方程式计算出AlN的物质的量,进而计算AlN的质量,利用质量分数的定义计算样品中AIN的质量分数;
(4)II中NH3极易被吸收,发生倒吸现象,同时氨气中含有水蒸气,影响氨气质量的测定,所以不可行.所作的改正为:在装置之间添加盛有碱石灰的干燥管,烧杯导管的末端接一倒扣的漏斗来吸收氨气.
解答 解:(1)依据题干信息“类金刚石氮化物”,通过硅类推AlN的晶体类型为原子晶体;反应物中有氧化铝固体可能未反应完而留在AlN中,
故答案为:原子晶体;Al2O3;
(2)①由于AlN跟氢氧化钠溶液反应生成NaAlO2、并放出NH3,其反应方程式为:AlN+NaOH+H2O=NaAlO2+NH3↑,生成NH3的物质的量为$\frac{3.36L}{22.4L/mol}$=0.15mol,根据氮元素守恒可知10.00g样品中含有AlN的物质的量为0.15mol,AlN的质量为0.15mol×41g/mol=6.15g,样品中AlN的质量分数为$\frac{6.15g}{10.0g}$×100%=61.5%,
故答案为:AlN+NaOH+H2O=NaAlO2+NH3↑;61.5%;
②反应产物可能CO2、CO或CO2和CO、CO2和O2的混合气体,根据气体产物的密度可计算出气体产物的平均相对分子质量为30,所以生成气体必定是CO2和CO混合气体.设混合气体中含有CO2xmol,CO ymol,根据氧原子守恒有2x+y=0.18…①,根据平均相对分子质量有44x+28y=30(x+y)…②,联立方程解得:x=0.02,y=0.14.所以,样品中C的质量为(0.02+0.14)×12=1.92g,故答案为:1.92;
(3)应先进行装置气密性检验,然后依次加入固体药品、液体药品,最后进行气体排出水的测量,确定产生气体体积;
故答案为:c、a、b、d;
①苯易挥发,酒精易挥发,挥发出来的气体对实验有影响,同时由于酒精易溶于水,也不能达到隔离的目的;CCl4密度大于水,不能起到隔离作用.而植物油既不溶于水,密度小于水也不易挥发,可以把氨气与水进行隔离;
故答案为:C;
②氨气的体积为aL(标况下)的物质的量为$\frac{aL}{22.4L/mol}$=$\frac{a}{22.4}$mol,由方程式AlN+NaOH+H2O=NaAlO2+NH3↑可知,样品中AlN的物质的量为=$\frac{a}{22.4}$mol,所以AlN的质量为$\frac{a}{22.4}$mol×41g/mol=$\frac{41a}{22.4}$g,样品中AIN的质量分数为$\frac{\frac{41a}{22.4}g}{wg}$×100%=$\frac{4100a}{22.4w}$%,故答案为:$\frac{4100a}{22.4w}$%;
(4)II中NH3极易被吸收,发生倒吸现象,同时氨气中含有水蒸气,影响氨气质量的测定,所以不可行.所作的改正为:在装置之间添加盛有碱石灰的干燥管,烧杯导管的末端接一倒扣的漏斗来吸收氨气.故答案为:不可行;在装置之间添加盛有碱石灰的干燥管,烧杯导管的末端接一倒扣的漏斗来吸收氨气.
点评 本题考查对实验原理的理解与实验操作评价、物质含量测定、化学计算等,难度中等,理解实验原理是关键,是对所学知识的综合运用,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力,学习中全面把握基础知识.


科目:高中化学 来源: 题型:选择题
| A. | ETFE的结构中,存在-CF2-CH2-CF2-CH2-连接方式 | |
| B. | 四氟乙烯与乙烯发生缩聚反应得到ETFE | |
| C. | 以乙烯为原料经过加成反应、取代反应可制得乙二醇 | |
| D. | ETFE材料是热固型(体形结构)的塑料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ①②③④⑤⑦ | C. | ①③④⑤⑧ | D. | ①②③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
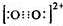 .CaC2晶胞结构与氯化钠晶体相似,则在晶体中与钙离子距离最近的C22-数目为6,这些C22-在空间所围成的几何图形为正八面体
.CaC2晶胞结构与氯化钠晶体相似,则在晶体中与钙离子距离最近的C22-数目为6,这些C22-在空间所围成的几何图形为正八面体查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①②③⑤⑥⑦ | C. | ①②④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含氧酸的酸性:X对应的强于Y对应的 | |
| B. | 气态氢化物的稳定性:HmX强于HnY | |
| C. | 第一电离能可能Y大于X | |
| D. | X与Y形成化合物时,X显负价,Y显正价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | A是反应物 | |
| B. | 前2 min A的分解速率为0.1 mol•L-1•min-1 | |
| C. | 达平衡后,若升高温度,平衡向正反应方向移动 | |
| D. | 反应的方程式为:2A(g)?2B(g)+C(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  给液体加热 | B. |  转移溶液 | C. |  称取NaOH固体 | D. |  量取液体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com