
�����ִ���ҵ�����Ȼ���Ϊԭ���Ʊ�������ֹ����������£�

��֪NaHCO3�ڵ������ܽ�Ƚ�С��
��Ӧ����NaCl+CO2+NH3+H2O NaHCO3��+NH4Cl������ĸҺ�����ַ�����
NaHCO3��+NH4Cl������ĸҺ�����ַ�����
��1����ĸҺ�м���ʯ���飬�ɽ�����________ѭ�����á�
��2����ĸҺ��ͨ��NH3������ϸС��ʳ�ο��������£��ɵõ�NH4Cl���塣��д��ͨ��NH3���ܽ�Ƚ�С����ʽ̼����ת��Ϊ�ܽ�Ƚϴ��̼���ε����ӷ���ʽ ___________��
����ij��ѧС��ģ���������Ƽ������NaCl��NH3��CO2��ˮ��Ϊԭ���Լ���ͼ��ʾװ����ȡNaHCO3��Ȼ���ٽ�NaHCO3�Ƴ�Na2CO3��

��1��װ�ñ�����ˮ�������� ��
��2����װ�ñ��в�����NaHCO3��ȡNa2CO3ʱ����Ҫ���е�ʵ�������_______��ϴ�ӡ����ա�NaHCO3ת��ΪNa2CO3�Ļ�ѧ����ʽΪ ��
��3�����ڣ�2�������յ�ʱ��϶̣�NaHCO3���ֽⲻ��ȫ����С���һ�ݼ�����t1 min��NaHCO3 ��Ʒ����ɽ���������̽����
ȡ������t1 min��NaHCO3��Ʒ29��6 g��ȫ����ˮ�Ƴ���Һ��Ȼ�������Һ�л����صμ�ϡ���ᣬ�����Ͻ��衣��������ļ��룬��Һ���й����ӵ����ʵ����ı仯��ͼ��ʾ��

������a��Ӧ����Һ�е�������___________�������ӷ�����ͬ��������c��Ӧ����Һ�е�������___________������Ʒ��NaHCO3��Na2CO3�����ʵ���֮���� �� 21
��4����ȡ21��0 g NaHCO3���壬������t2 rnin��ʣ����������Ϊl4��8 g������Ѵ�ʣ�����ȫ�����뵽200 mL 2 mol?L��1�������У����ַ�Ӧ����Һ��H+ �����ʵ���Ũ��Ϊ____________������Һ����仯���Բ��ƣ�
����1��NH3
��2��HCO3�C+NH3=NH4++CO32�C
������1����ȴ��ʹ̼�����ƾ�������
��2������ 2NaHCO3 Na2CO3+H2O+CO2��
Na2CO3+H2O+CO2��
��3��Na+ HCO3- 1:2
��4��0��75 mol/L
��������
�������������1��������NaHCO3������ĸҺNH4Cl�м������ʯ���飬�����ķ�Ӧ��Ca��OH��2+2NH4Cl=2NH3��+2H2O+CaCl2�����ղ���Ϊ�Ȼ��ơ����������а����������ã��ʴ�Ϊ��NH3��
��2��ͨ��NH3���ܽ�Ƚ�С����ʽ̼����ת��Ϊ�ܽ�Ƚϴ��̼���ε����ӷ���ʽHCO3�C+NH3=NH4++CO32�C��
������1��װ�ñ�����ˮ�������ǽ��£�ʹ̼�����ƾ���������
��2����װ�ñ��в�����NaHCO3�����ķ�ӦΪ��NH3+CO2+H2O+NaCl=NaHCO3��+NH4Cl����ȡNa2CO3ʱ��Ҫ���˵õ����壬ϴ�Ӻ�������յõ�̼���ƣ�2NaHCO3 Na2CO3+H2O+CO2��
Na2CO3+H2O+CO2��
��3����Һ���й����ӵ����ʵ����ı仯Ϊ��������ʼ�ղ��䣬̼������Ӽ�С��̼���������Ũ������̼�������ȫ��ת��Ϊ̼��������ӣ��ٵ��������̼��������ӷ�Ӧ���ɶ�����̼��̼��������Ӽ�С������c���߱�ʾ����̼���������Ũ�ȱ仯��̼�������Ũ��0��2mol/L��̼���������Ũ��Ϊ0��1mol/L����Ʒ��NaHCO3��Na2CO3�����ʵ���֮����1��2�� �ʴ�Ϊ��Na+ ��HCO3-�� 1��2��
��4����ȡ21g NaHCO3�������ʵ���=21g/84g/mol=0��25mol��
������t1min��ʣ����������Ϊ14��8g�����ݻ�ѧ����ʽ���ڵ������仯���㣺
2NaHCO3=Na2CO3+CO2��+H2O ��m
2 1 62
0��2mol 0��1mol 21g-14��8g
��Ӧ��NaHCO3���ʵ���=0��25mol-0��2mol=0��05mol��NaHCO3+HCl=NaCl+H2O+CO2���������Ȼ������ʵ���0��05mol��
Na2CO3���ʵ���=0��1mol��Na2CO3+2HCl=2NaCl+H2O+CO2���������Ȼ������ʵ���0��2mol��
ʣ���Ȼ������ʵ���=0��200L��2mol/L-0��05mol-0��2mol=0��15mol��ʣ����Һ��c��H+��=
0��15mol/0��2L=0��75mol/L�ʴ�Ϊ��0��75mol/L
���㣺��ҵ�ƴ����ԭ�����������������е����ʱ仯�������ɷֵķ����жϺ�ͼ������������Ӧ�á�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016���㽭ʡ��һ��ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���е��뷽��ʽ��д��������� ��
A��CaCl2=Ca2++2Cl�� B��H2CO3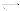 H����HCO3��
H����HCO3��
C��NaHCO3��Na����H����CO32�� D��NaClO=Na++Cl O��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���㽭ʡ�����и�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���б仯�У��������������ʵ�ֵ���
A��NaClO ��NaCl B��Na2O2 �� O2 C��C �� CO2 D��CaO��Ca(OH)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���㽭ʡ����������У��һ12��������ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͬ��ͬѹ�£�A�����е�������O2����B�����еİ�����NH3��������ԭ�Ӹ�����ͬ����A��B����������������֮���� �� ��
A��1��2 B��2��1 C��2��3 D��3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���㽭ʡ����������У��һ12��������ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ�������װ����ȷ������ ��
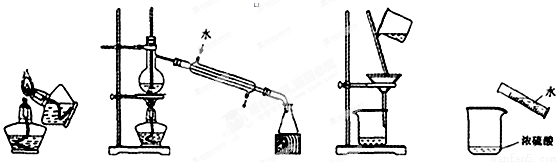
A����ȼ�ƾ��� B������ C������ D��ϡ��Ũ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���㽭ʡ�����и�һ��ѧ����ĩģ�⿼�Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�й���ͼ��ʵ���������ȷ���� ( )
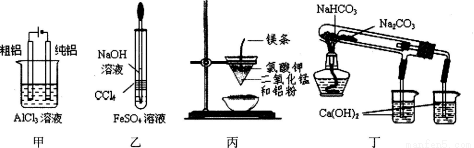
A���ü�ͼװ�õ�⾫����
B������ͼװ���Ʊ�Fe(OH)2
C����ͼװ�ÿ��Ƶý����̣���ͬ����װ�ÿ��Ƶý�����
D����ͼ��֤NaHCO3��Na2CO3���ȶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���㽭ʡ�����и�һ��ѧ����ĩģ�⿼�Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͭ�۷���װ��Ũ��ˮ���Թ��У������Թ����������Թ���Խ��Խ��������Һ��Ϊdz��ɫ��������ɫ����Һ�����Թ�������ҺѸ�ٱ�Ϊ��ɫ��Һ��������˵����ȷ���ǣ� ��
A���Թ���Խ��Խ��������Ϊ��Ӧ�����˴���NH3
B����Һ��Ϊdz��ɫ������Ϊ��Ӧ������������NO2
C����ҺѸ�ٱ�Ϊ��ɫ��Һ������Ϊ��Ӧ������
D��������Ӧԭ�������ڲⶨO2�ĺ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���㽭ʡ��һ��ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��һ�������£�CO��CH4ȼ�յ��Ȼ�ѧ����ʽ�ֱ�Ϊ��
2CO(g)+O2(g)=2CO2(g), ��H= -566kJ��mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l), ��H= -890kJ��mol-1
��1 mol CO��3 mol CH4��ɵĻ��������������������ȫȼ��ʱ���ͷŵ�����Ϊ�� ��
A��2912 kJ B��2953 kJ C��3236 kJ D��3867 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���㽭ʡ�����и�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
2013��12��2�����϶������������״���������½����Я���ĺ��ܵ���ֳƷ�����ͬλ�ط���װ�á������йؼ�ԭ�ӵ�ԭ�ӽṹ�٢ڢ���������ȷ���ǣ����� ��ʾ���ӣ�
��ʾ���ӣ� ��ʾ���ӣ�
��ʾ���ӣ� ��ʾ���ӣ�
��ʾ���ӣ�
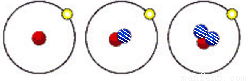
�� �� ��
A���٢ڢ����������ӡ����ӡ�������ɵ�
B���٢ڢ���Ϊ��Ԫ�ص�һ�ֺ���
C���٢ڢ�������ͬ��������
D���٢ڢ������ֻ�ѧ������ȫ��ͬ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com