
| A. | 在氧化还原反应中,金属单质一定是还原剂,非金属单质一定是氧化剂 | |
| B. | 某元素在化学反应中,由化合态变为游离态,则该元素一定被还原 | |
| C. | 在氧化还原反应中,氧化剂和还原剂可能是同一种物质 | |
| D. | 有单质生成的反应一定是氧化还原反应 |
分析 A.非金属单质在反应中可能得到或失去电子,而金属单质在反应中一定失去电子;
B.由化合态变为游离态,可能得到或失去电子;
C.同种物质可能得到也同时失去电子;
D.有单质生成的反应,不一定存在元素的化合价变化.
解答 解:A.非金属单质在反应中可能得到或失去电子,如氯气与水的反应中氯气为氧化剂也为还原剂,而金属单质在反应中一定失去电子,金属只能为还原剂,故A错误;
B.由化合态变为游离态,可能得到或失去电子,如发生Fe+Cu2+=Fe2++Cu,则被还原,如发生Cl2+S2-=2Cl-+S,则被氧化,故B错误;
C.同种物质可能得到也同时失去电子,如氯气与水的反应中氯气为氧化剂也为还原剂,故C正确;
D.有单质生成的反应,不一定存在元素的化合价变化,如金刚石与石墨的转化为非氧化还原反应,故D错误;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握氧化还原反应的特征及反应中元素的化合价变化为解答的关键,侧重基本概念的考查,注意结合实例解答,题目难度不大.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2既是氧化剂又是还原剂 | B. | H2O2是氧化剂 | ||
| C. | O2既是氧化产物又是还原产物 | D. | 该反应转移4mole- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
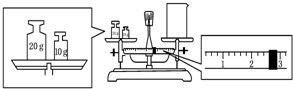 实验室欲用NaOH固体配制1.0mol•L-1的NaOH溶液250mL:
实验室欲用NaOH固体配制1.0mol•L-1的NaOH溶液250mL:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
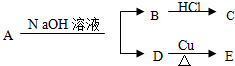 ,又已知D不与Na2CO3溶液反应,C和E都不能发生银镜反应.A的结构可能有( )
,又已知D不与Na2CO3溶液反应,C和E都不能发生银镜反应.A的结构可能有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. ,
, .
. .
. )发生酯化反应而生成的,写出F→G的反应的化学方程式CH2=C(CH3)COOCH2CH2OH+
)发生酯化反应而生成的,写出F→G的反应的化学方程式CH2=C(CH3)COOCH2CH2OH+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +H2O.
+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com