
【题目】a,b,c,d为四种由短周期元素构成的中性粒子,它们都有14个电子,且除a外都是共价型分子。回答下列问题:
(1)a是单核粒子,a单质可用作半导体材料,a原子核外电子排布式为______________。
(2)b是双核化合物,常温下为无色无味气体。b的化学式为________。人一旦吸入b气体后,就易引起中毒,是因为__________而中毒。
(3)c是双核单质,写出其电子式____________。c分子中所含共价键的类型为_______(填“极性键”或“非极性键”)。c单质常温下性质稳定,不易起反应,原因是________________________。
(4)d是四核化合物,其结构式为______________;d分子内所含共价键有________个σ键,________个π键;σ键与π键的强度大小关系为σ___π(填“>”、“<”或“=”),原因是:__________。
【答案】1s22s22p63s23p2 CO CO一旦被吸入肺里后,会与血液中的血红蛋白结合,使血红蛋白丧失输送氧气的能力 ![]() 非极性键 N2分子中的共价叁键键能很大,共价键很牢固 H—C≡C—H 3 2 > 形成σ键的原子轨道的重叠程度比π键的重叠程度大,形成的共价键强
非极性键 N2分子中的共价叁键键能很大,共价键很牢固 H—C≡C—H 3 2 > 形成σ键的原子轨道的重叠程度比π键的重叠程度大,形成的共价键强
【解析】
从a,b,c,d为四种由短周期元素构成的中性粒子,它们都有14个电子入手,并结合题目分析,a是Si;b是CO;c是N2;d是C2H2;
(1)a是Si,根据构造原理知,Si原子的电子排布式为1s22s22p63s23p2;
(2)b是两个原子的化合物,根据其物理性质:无色无味气体,推断b为CO,CO一旦进入肺里,会与血液中的血红蛋白结合而使血红蛋白丧失输送氧气的能力,使人中毒;
(3)c是双原子单质,每个原子有7个电子,故c为N2,N2分子的结构式为N≡N,为非极性键,N2分子中的共价叁键键能很大,所以N2分子很稳定,其电子式为:![]() ;
;
(4)d是四核化合物,即4个原子共有14个电子,d为C2H2,C2H2的结构式为H—C≡C—H,有两个H—C σ键,一个C—C σ键,两个π键。形成σ键的原子轨道的重叠程度比π键的重叠程度大,故形成的共价键强。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式:SiCl4(g)+2H2(g) ![]() Si(s)+4HCl(g) ΔH=+Q kJ·mol-1(Q>0)。某温度、压强下,将一定量的反应物通入密闭容器中进行以上反应(此条件下为可逆反应),下列叙述正确的是
Si(s)+4HCl(g) ΔH=+Q kJ·mol-1(Q>0)。某温度、压强下,将一定量的反应物通入密闭容器中进行以上反应(此条件下为可逆反应),下列叙述正确的是
A. 反应过程中,若增大压强能提高SiCl4的转化率
B. 若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ
C. 当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液中恰好反应
D. 反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/( L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期主族元素A、B、C、D、E的原子序数依次增加,五种元素中C的原子半径最大,B与E同主族,D的氧化物既能与酸反应也能与碱反应,E的氧化物是形成酸雨的主要原因,A与E形成的化合物是下水道中具有特殊气味的气体。下列说法正确的是
A. 1molA2B2中所含的共用电子对数目为3NA
B. A2E水溶液的电离方程式为A2E![]() 2A++E2-
2A++E2-
C. 最高价氧化物对应的水化物的酸性:D>E
D. 简单氢化物的热稳定性:B>E,是因为B的氢化物分子间含有氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室合成溴苯的装置图及有关数据如下,按下列合成步骤回答:


(1)实验装置中,仪器c的名称为________________,作用为_______________。
(2)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白雾产生,是因为生成了_______气体。继续滴加至液溴滴完。写出a中发生反应的化学方程式:_________________________________________。
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是____________________________________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入无水氯化钙的目的是_______________。
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为____________,要进一步提纯,需进行的操作方法为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2O2的结构如下图:

H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书页角为93°52′,而两个O—H键与O—O键的夹角均为96°52′,试回答:
(1)写出H2O2分子的电子式和结构式。___________
(2)写出分子内的键型。__________
(3)估计它难溶于CS2,简要说明原因。_________
(4)指出氧元素的化合价,简要说明原因。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值, 下列叙述正确的是
A. 1mol H2O中含有的极性共价键数目为2NA
B. 16 g16O2和18O2混合物中含有的质子数目为8NA
C. Zn和浓硫酸反应得到22.4LSO2和 H2混合气体时, 转移的电子数为4NA
D. 标准状况下2 mol NO与1 mol O2充分反应后分子数共2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为原子序数依次增大的短周期主族元素,其中Y元素在同周期中离子半径最小;甲、乙分别是元素Y、Z的单质;丙、丁、戊是由W、X、Y、Z元素组成的二元化合物,常温下丁为液态;戊为酸性气体,常温下0.01mol·L-1戊溶液的pH大于2。上述物质转化关系如图所示。下列说法正确的是
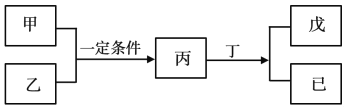
A. 原子半径:Z>Y>X>W
B. W、X、Y、Z不可能同存于一种离子化合物中
C. W和Ⅹ形成的化合物既可能含有极性键也可能含有非极性键
D. 比较X、Z非金属性强弱时,可比较其最高价氧化物对应的水化物的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,体积为6.72L的CO质量为___,CO物质的量为____,CO分子数为____,CO摩尔质量为____。
(2)在标准状况下,体积为8.96 L的CO和CO2的混合气体共14.4g。CO的质量为____g。CO的体积为___L。混合气体的平均摩尔质量为___g·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用等浓度的NaOH溶液分別滴定相同体积的NH4Cl、KH2PO4及CH3COOH溶液,滴定曲线如图所示,下列说法正确的是( )

A. NH3 ·H2O![]() NH4+ +OH- 的 lg Kb=-9.25
NH4+ +OH- 的 lg Kb=-9.25
B. CH3COOH+HPO42-=CH3 COO-+H2 PO4-的 lg K =2.11
C. 0.1mol/LKH2PO4溶液中:c(HPO42-)<c(H3PO4)
D. 在滴定过程中,当溶液pH相同时,消耗NaOH的物质的量:CH3COOH<KH2PO4<NH4Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com