
已知:
① CaCO3 (s) ![]() CaO (s) + CO2 (g) Δ H = +178.2 kJ·mol-1
CaO (s) + CO2 (g) Δ H = +178.2 kJ·mol-1
② 2Na (s) + Cl 2 (g) ![]() 2NaCl (s) Δ H = -822.0 kJ·mol-1
2NaCl (s) Δ H = -822.0 kJ·mol-1
③ H-H、Cl-Cl和 H-Cl的键能分别为436 kJ·mol-1、243 kJ·mol-1和431 kJ·mol-1
则:
(1)上述反应①②中属于放热反应的是 (填序号)。
(2)根据②计算生成1 mol NaCl(s)时,Δ H = ____ kJ·mol-1。
(3)根据③推算:Cl 2 (g) + H2 (g) ![]() 2HCl (g) 的Δ H = kJ·mol-1。
2HCl (g) 的Δ H = kJ·mol-1。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| HA | H2B | HC | ||
| Ka | Ka1 | Ka2 | Ka | |
| 数值 | 1.8×10-5 | 4.3×10-7 | 5.6×10-11 5.6×10-11 |
4.9×10-10 4.9×10-10 |
 (3)如图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数.
(3)如图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数.查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SiO2是硅酸的酸酐,SiO2溶于水显酸性,将SiO2固体溶于水即得硅酸胶体 | ||||
| B、碳酸的酸性弱于硅酸的酸性,CO2通入Na2SiO3溶液中可得硅酸 | ||||
C、已知高温下CaCO3+SiO2
| ||||
| D、CO2是碳酸的酸酐,将CO2气体溶于水即是碳酸溶液 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省十三校高三3月第一次联考化学试卷(解析版) 题型:选择题
海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
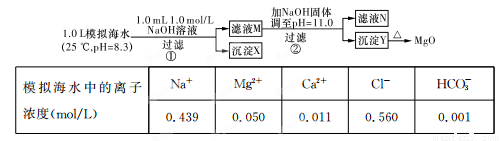
注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变。已知:KSp(CaCO3)=4.96×10-9;KSp(MgCO3)=6.82×10-6;KSp[Ca(OH)2]=4.68×10-6;KSp[Mg(OH)2]=5.61×10 -12。
下列说法不正确的是
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+和Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y只有Mg(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com