
| A. | 移走少量C | B. | 扩大容积,减小压强 | ||
| C. | 缩小容积,增大压强 | D. | 容积不变,充入“惰”气 |
分析 该反应为气体体积减小、放热的反应,使正反应速率v正增大、D的物质的量浓度c(D)增大,可增大压强,使反应速率加快,平衡正向移动,以此来解答.
解答 解:A.C为固体,移走少量C,速率不变、平衡不移动,故A不选;
B.扩大容积,减小压强,反应速率减小,平衡逆向移动,故B不选;
C.缩小容积,增大压强,使反应速率加快,平衡正向移动,c(D)增大,故C选;
D.容积不变,充入“惰”气,浓度不变,反应速率不变,平衡不移动,故D不选;
故选C.
点评 本题考查化学平衡移动,为高频考点,把握反应的特点、压强和浓度对平衡的影响为解答的关键,侧重分析与应用能力的考查,注意C为固体,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
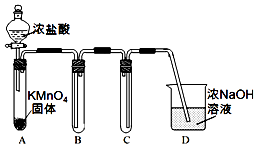 某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.
某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.| 烧杯编号 | 1 | 2 | 3 | 4 |
| 氯酸钾饱和溶液 | 1mL | V1mL | V2mL | V3mL |
| 氯化钾固体 | 1g | 1g | 1g | 1g |
| 水 | 8mL | V4mL | 3mL | 0mL |
| 硫酸(6mol/L) | V5mL | 2mL | V6mL | 8mL |
| 现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 相应实验现象 | 结论或推论 | |
| A | 溴水中加入苯,充分振荡、静置 | 水层几乎呈无色 | 苯与溴发生了反应 |
| B | 一小粒金属钠投入装有无水乙醇的试管中 | 反应结束前一段时间,钠浮在乙醇表面 | 密度:乙醇大于钠 |
| C | 分别向盛有KI3溶液的a、b试管中滴加淀粉溶液和AgNO3溶液 | a中溶液变蓝,b中产生黄色沉淀 | KI3溶液中存在:I3-?I2+I- |
| D | 分别向含Mn2+的草酸溶液X和不含Mn2+的草酸溶液Y中滴加酸性高锰酸钾溶液 | 高锰酸钾溶液在X溶液中褪色较快 | Mn2+也能还原高锰酸钾 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3 g钠由原子变成离子时,失去的电子数为1NA | |
| B. | 0.2NA个硫酸分子与19.6 g磷酸含有相同的氧原子数 | |
| C. | 28 g氮气所含原子数为NA | |
| D. | NA个氧分子与NA个氢分子的质量比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
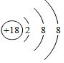 .元素⑤名称为Al在周期表中的位置第三周期ⅢA族.元素④与元素⑤最高价氧化物的水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
.元素⑤名称为Al在周期表中的位置第三周期ⅢA族.元素④与元素⑤最高价氧化物的水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O. .
. ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物. ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:1 | C. | 1:3 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu与Cu2S的物质的量之比为10:1 | |
| B. | 硝酸的物质的量浓度为1.2mol/L | |
| C. | Cu(OH)2沉淀质量为29.4g | |
| D. | Cu、CuS与硝酸反应后剩余HNO3为0.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
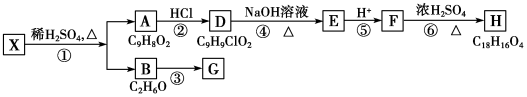
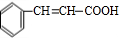 ,检验A中非含氧官能团所用的试剂为溴水或溴的四氯化碳溶液.
,检验A中非含氧官能团所用的试剂为溴水或溴的四氯化碳溶液.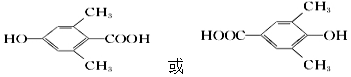 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com