
| 44.8L |
| 22.4L/mol |
| 73g+492g |
| 1.13×103g/L |
| n |
| V |
| 44.8L |
| 22.4L/mol |
| 73g+492g |
| 1.13×103g/L |
| n |
| V |
| 2mol |
| 0.5L |
| 1 |
| 2 |
| n |
| V |


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
| A、NA |
| B、2NA |
| C、3NA |
| D、4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
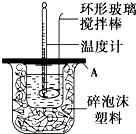 分别取40mL的0.50mol/L盐酸与0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题:
分别取40mL的0.50mol/L盐酸与0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | a的取值范围 | 产物的化学式(或离子符号) |
| A | a≤1/6 | I2 Br- H2O |
| B | 1/6<a<1/5 | |
| C | a=1/5 | I2 Br2 H2O |
| D | 1/5<a<6/5 | I2 IO3- Br2 H2O |
| E | a≥6/5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
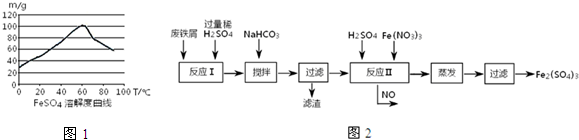
| n(Fe) |
| n(H2SO4) |
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 | 4.7 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
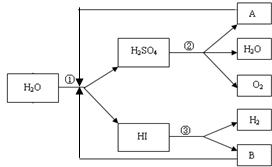 人类研究氢能源从未间断过,而热化学循环分解水制氢气是在水反应体系中加入一种中间物,经历不同的反应阶段,最终将水分解为氢气和氧气,这是一种节约能源、节省反应物料的技术,如图是一个热化学循环制氢气法的流程:
人类研究氢能源从未间断过,而热化学循环分解水制氢气是在水反应体系中加入一种中间物,经历不同的反应阶段,最终将水分解为氢气和氧气,这是一种节约能源、节省反应物料的技术,如图是一个热化学循环制氢气法的流程:查看答案和解析>>
科目:高中化学 来源: 题型:
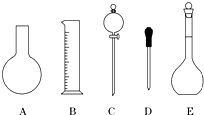 实验室用氯化钠固体配制1.00mol/L的NaCl溶液0.5L,回答下列问题
实验室用氯化钠固体配制1.00mol/L的NaCl溶液0.5L,回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com