
【题目】为验证氧化性:Cl2>Fe3+>SO2,某化学研究性学习小组用如图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕):
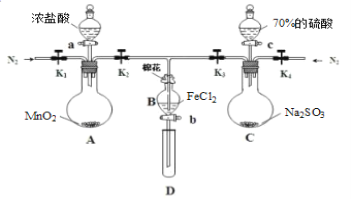
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的阳离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_____________。
(2)棉花中浸润的溶液为________________,作用是____________ 。
(3)导致步骤Ⅲ中溶液变黄的离子反应是__________,用________(写试剂化学式)检验氧化产物,现象是____________。
(4)能说明氧化性Fe3+>SO2的离子方程式是___________。
(5)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:Cl2>Fe3+>SO2的是_______(填“甲”“乙”“丙”)。
过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有 |
乙 | 既有Fe3+又有Fe2+ | 有 |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
【答案】排除装置中的空气,制造无氧环境 氢氧化钠 吸收逸出的二氧化硫和氯气 Cl2 +2Fe2+ =2Fe3+ +2Cl- KSCN溶液 溶液变为血红色 2Fe3+ + SO2 + 2H2O = 2Fe2+ + 4H+ +![]() 乙 和 丙
乙 和 丙
【解析】
本实验目的是验证氧化性:Cl2>Fe3+>SO2,根据氧化还原反应的规律可知,若氯气可以氧化Fe2+生成Fe3+,则可以证明氯气的氧化性大于Fe3+,Fe3+可以氧化SO2生成SO![]() 则可以证明Fe3+氧化性大于SO2。据此进行实验,首先为避免氧气的影响,所以要先用氮气排尽装置中的空气,之后利用装置A制取氯气,通入B装置中,通过溶液的颜色变化确定氯化亚铁被氧化成氯化铁;之后再利用装置C制取SO2,通入装置B中,再次通过溶液的颜色变化确定SO2将Fe3+还原成Fe2+;浸有碱液的棉花可以吸收未反应的氯气和二氧化硫。
则可以证明Fe3+氧化性大于SO2。据此进行实验,首先为避免氧气的影响,所以要先用氮气排尽装置中的空气,之后利用装置A制取氯气,通入B装置中,通过溶液的颜色变化确定氯化亚铁被氧化成氯化铁;之后再利用装置C制取SO2,通入装置B中,再次通过溶液的颜色变化确定SO2将Fe3+还原成Fe2+;浸有碱液的棉花可以吸收未反应的氯气和二氧化硫。
(1)空气中的氧气具有氧化性,会干扰实验,所以需要先通氮气,排除装置中的空气,制造无氧环境;
(2)二氧化硫和氯气均有毒,需要进行尾气处理,可以用浸有NaOH溶液的棉花来吸收逸出的二氧化硫和氯气;
(3)步骤Ⅲ中氯化亚铁被氯气氧化成氯化铁,溶液颜色发生变化,离子方程式为Cl2 +2Fe2+ =2Fe3+ +2Cl-;可以用KSCN溶液检验Fe3+,有Fe3+生成时,溶液会变为血红色;
(4)Fe3+可以氧化SO2生成SO![]() ,离子方程式为2Fe3++SO2+2H2O = 2Fe2++4H++
,离子方程式为2Fe3++SO2+2H2O = 2Fe2++4H++![]() ;
;
(5)甲:IV中B溶液含有铁离子说明氧化性Cl2>Fe3+,VI中B溶液含有硫酸根离子,若B溶液中氯气有剩余,则氯气会氧化二氧化硫生成硫酸根离子,不能判断氧化性Fe3+>SO2;
乙:IV中B溶液含有Fe3+和Fe2+,说明氧化性Cl2>Fe3+且氯气不足,所以VI中B溶液含有硫酸根离子,则一定是Fe3+氧化二氧化硫为硫酸根离子,所以判断氧化性Fe3+>SO2,因此可得氧化性Cl2>Fe3+>SO2的结论;
丙:IV中B溶液含有铁离子说明氧化性Cl2>Fe3+,VI中B溶液含有Fe2+,若是氯气氧化二氧化硫,不会有Fe2+生成,说明铁离子与二氧化硫发生氧化还原反应,Fe3+被还原为Fe2+,所以氧化性Fe3+>SO2,因此可得氧化性Cl2>Fe3+>SO2的结论;
综上所述能够证明氧化性:Cl2>Fe3+>SO2的是乙、丙。


科目:高中化学 来源: 题型:
【题目】以下是反应A(g) + 3B(g) 2C(g) + 2D(g) 在四种不同情况下的反应速率,反应速率最大的是
A. υ(A)=0.45mol·L-1·s-1B. υ(B)=0.6mol·L-1·s-1
C. υ(C)=0.4mol·L-1·s-1D. υ(D)=0.45mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】祖母绿的主要成分为Be3Al2Si6Ol8,含有O、Si、Al、Be等元素。请回答下列问题:
(1)基态A1原子中,电子占据的最高能级的符号是_______________________,该能级具有的原子轨道数为_______。
(2)在1000℃时,氯化铍以BeCl2形式存在,其中Be原子的杂化方式为_________;在500600℃气相中,氯化铍则以二聚体Be2Cl4的形式存在,画出Be2Cl4的结构____________,1molBe2Cl4中含有____mol配位键。
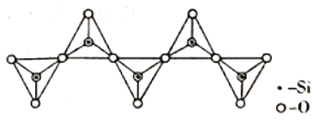
(3)氢化铝锂(LiAlH4)是有机合成中一种重要的还原剂,LiAlH4的阴离子的空间构型为____________,该阴离子的等电子体为____________(写一种分子、一种离子)。一种无限长单链结构的多硅酸根的一部分如图所示,则该硅酸根的化学式为____________________。
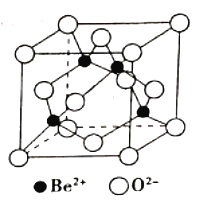
(4)用氧化物的形式表示出祖母绿的组成:___________。如图是Be与O形成的氧化物的立方晶胞结构,已知氧化铍的密度为ρg/cm3,则晶胞边长为__________cm。(设NA为阿伏加德罗常数的值,用含ρ、NA的代数式表示),O2-的配位数为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种晶体的晶胞如图所示:
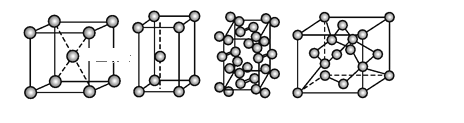
所示晶胞从左到右分别表示的物质正确的排序是
A. 碘、锌、钠、金刚石B. 金刚石、锌、碘、钠
C. 钠、锌、碘、金刚石D. 锌、钠、碘、金刚石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物广泛存在于自然界中。回答下列问题:
(1)在基态14C原子中,核外存在______对自旋相反的电子。
(2)碳在形成化合物时,其键型以共价键为主,原因是__________。
(3)CS2分子中,共价键的类型有________,C原子的杂化轨道类型是______,写出两个与CS2具有相同空间构型和键合形式的分子或离子_______。
(4)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
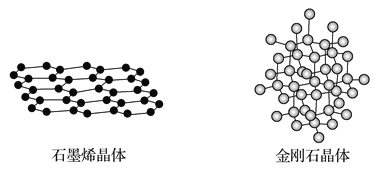
①在石墨烯晶体中,每个C原子连接_____个六元环,每个六元环占有___个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接_____个六元环,六元环中最多有______个C原子在同一平面。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核磁共振谱(NMR)是研究有机化合物结构的重要手段。在所研究的化合物分子中,等性氢原子在NMR谱中都给出了相应的峰(信号),谱中峰的强度与结构中氢原子数成正比。如乙醛分子(CH3CHO)的NMR谱中有2个峰,其强度比是3∶1。乙醇分子(CH3CH2OH)的NMR谱中有3个峰,其强度比是 3∶2∶1。
(1)苯的NMR谱中应该有________个峰;甲苯的NMR谱中有_______个峰。
(2)某化合物C3H6O2的NMR谱中有3个峰,其强度比为3∶2∶1,则该化合物的结构简式可能为______。
(3)研究发现,结构简式为CH3CH![]() CHCl的化合物的NMR谱中有6个峰,原因是_____。
CHCl的化合物的NMR谱中有6个峰,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种有机玻璃的结构简式为 。下列关于它的叙述中不正确的是( )
。下列关于它的叙述中不正确的是( )
A. ![]() 在一定条件下发生缩聚反应即可合成该有机玻璃
在一定条件下发生缩聚反应即可合成该有机玻璃
B. 该有机玻璃能发生氧化反应
C. 合成该有机玻璃的原料可能有甲烷
D. 它在一定条件下发生水解反应时C—O键断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人造羊毛的主要成分为![]() ,此物质可由以下三种途径合成,已知A是石油分馏的一种产品,A均裂可生成等物质的量的C2H4和C2H6。
,此物质可由以下三种途径合成,已知A是石油分馏的一种产品,A均裂可生成等物质的量的C2H4和C2H6。
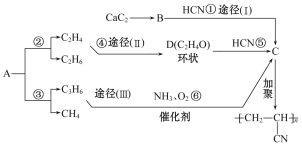
回答下列问题:
(1)写出A的分子式______,D的结构式______。
(2)在反应①~⑥中,属于加成反应的是________。
(3)写出反应⑥的化学反应方程式:____________。
(4)从能源和环保的角度看,你认为最有发展前景的是_____,其中的理由是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计及其对应的离子方程式均正确的是
A.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO![]() + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
+ 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
B.Na2O2与H2O反应制备O2 :Na2O2 + H2O = 2Na+ + 2OH- + O2↑
C.将氯气溶于水制备次氯酸:Cl2 + H2O = 2H+ + Cl- + ClO-
D.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+ = Cu2+ + 2Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com