
黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为:
2KNO3+3C+S K2S+N2↑+3CO2↑
K2S+N2↑+3CO2↑
(1)上述反应中,原子半径最小的元素其原子结构示意图为________________。
(2)上述反应生成物中,属于非电解质的是________。
(3)上述反应中,每生成1 mol氧化产物,消耗KNO3的质量为 (保留1位小数)。
(4)收集黑火药爆炸后的烟尘和气体产物,分别与酸性高锰酸钾溶液反应,均能使溶液紫红色退去。
①烟尘中能使酸性高锰酸钾溶液退色的物质是 (填化学式)。
②气体产物与酸性高锰酸钾溶液反应的离子方程式 。
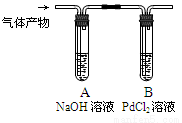
③利用下图装置检验气体产物中的CO气体,一段时间后,观察到B中出现黑色的Pd沉淀,写出B中发生反应的化学方程式 。
(1) (2分) (2)CO2(2分) (3)67.3(2分)
(2分) (2)CO2(2分) (3)67.3(2分)
(4)①K2S(2分)
②5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+(3分)
③CO+PdCl2+H2O=Pd+2HCl+CO2(3分)
【解析】
试题分析:(1)根据同周期元素原子半径随原子序数的递增逐渐减小,同主族元素原子半径随原子序数的递增逐渐增大,原子半径最小的元素是O。(2)在熔融状态下和水溶液中都不导电的化合物为非电解质,故CO2是非电解质。(3)该反应中C化合价升高发生氧化反应,氧化产物为CO2,根据化学方程式可以看出,每生成3mol CO2,消耗2mol KNO3,故生成1mol CO2,消耗2/3mol KNO3,质量为2/3mol×101g/mol=67.3g。(4)①黑火药爆炸后的烟尘中含有K2S,具有还原性;②黑火药爆炸时,S也会与空气中的氧气反应生成SO2,故气体产物中的SO2具有还原性,反应离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;③利用右图装置检验气体产物中的CO气体,NaOH吸收了酸性气体,CO具有还原性,B中发生反应的化学方程式为CO+PdCl2+H2O=Pd+2HCl+CO2。
考点:考查化学用语的书写、氧化还原反应、物质的性质等内容。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源:2013-2014福建省高三5月校质检理综化学试卷(解析版) 题型:选择题
下列实验能达到目的的是( )
|
|
|
|
A. 检验SO2具有漂白性 | B.配制0.1 mol?L-1NaOH溶液时定容 | C.分离出碘水中的碘 | D.配制一定浓度硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(-57.3) kJ/mol
B.CO(g)的燃烧热是283.0 kJ/mol,则表示CO燃烧热的热化学方程式为CO(g)+1/2O2(g)===CO2 (g);△H=-283.0 kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1 mol硫燃烧生成气态三氧化硫所放出的热量是硫磺的燃烧热
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省四地六校高三高考模拟试理综化学试卷(解析版) 题型:填空题
(16分)X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16。在适当条件下三种单质两两化合,可发生如右图所示变化。己知l个B分子中含有Z元素的原子个数比C分子中含有Z元素的原子个数少1个。请回答下列问题:
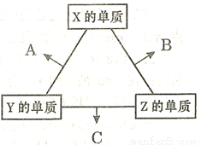
(1)由 X、Y、Z三种元素共同组成的三种不同种类的常见化合物的化学式为 ,相同浓度上述水溶液中由水电离出的c(H+)最小的是 (填写化学式)。
(2)Allis-Chalmers制造公司发现可以用C作为燃料电池的燃料,以氢氧化钾溶液为介质,反应生成对环境无污染的常见物质,试写出该电池负极的电极反应式 ,溶液中OH-向 极移动(填“正”或“负”)。
(3)Z分别与X、Y两元素可以构成18个电子分子甲和乙,其分子中只存在共价单键,常温下甲、乙均为无色液体,甲随着温度升高分解速率加快。
①乙能够将CuO还原为Cu2O,已知每lmol乙参加反应有4mole- 转移,该反应的化学方程式为 。
②将铜粉末用10%甲和3.0mol?L-1H2SO4混合溶液处埋,测得不同温度下铜的平均溶解速率如下表:
温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜的平均溶解速率 (×10-3mol?L-1·min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
由表中数据可知,当温度高于40℃时,铜的平均溶解速率随着温度的升高而下降,其主要原因是
_____________________________________________________。
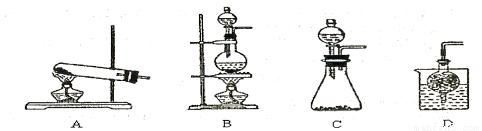
③实验室可用甲作试剂取X的单质,发生装置可选用下图中的 (填装置代号)。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省四地六校高三高考模拟试理综化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A. 服用铬含量超标的药用胶囊会对人对健康造成危害
B. 食用一定量的油脂能促进人体对某些维生素的吸收
C.CH4和Cl2在光照条件下反应的产物最多可能有四种
D.无论乙烯的加成,还是乙烯使酸性KMnO4溶液褪色,都与分子内含有碳碳双键有关
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高三热身考试化学试卷(解析版) 题型:选择题
室温下,对于醋酸及其盐的下列判断正确的是

A.稀醋酸溶解石灰石的离子方程式为
CaCO3+2H+=Ca2++H2O+CO2↑
B.稀醋酸加水稀释后,溶液中c(CH3COO-)/c(CH3COOH)变大
C.向稀醋酸中加入等浓度的NaOH溶液,导电能力变化如右图
D.CH3COONH4溶液和K2SO4溶液均显中性,两溶液中水的电离程度相同
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省南平市毕业班质量检查理综化学试卷(解析版) 题型:简答题
(15分)A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀或损坏。请回答下列问题:
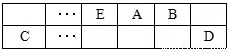
(1)A元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为 。
(2)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若所得溶液的pH=7,则a b(填“>"或“<”或“=”)
(3)常温下,相同浓度F、G简单离子的溶液中滴加NaOH溶液,F、G两元素先后沉淀,F (OH)n完全沉淀的pH是4.7,G (OH)n完全沉淀的pH是2.8,则ksp较大的是: (填化学式)
(4)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有: 。
①酸雨 ②温室效应③光化学烟雾 ④臭氧层破坏
(5)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是 。
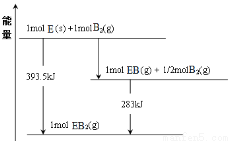
(6)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如下左图所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式 。
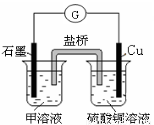
(7)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如上右图所示,其反应中正极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是
A.Mg2+ + 2HCO3- + 2Ca2+ + 4OH-= Mg(OH)2↓+ 2CaCO3↓+ 2H2O
B.Cu2+ + H2S = CuS↓+ 2H+
C.Zn2+ + S2- + 2H2O = Zn(OH)2↓+ H2S↑
D.FeS + 2H+ = Fe2+ + H2S↑
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高一下学期期末考试化学试卷(解析版) 题型:选择题
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
A.NH3的结构式为: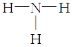 B.乙烯的结构简式: CH2CH2
B.乙烯的结构简式: CH2CH2
C.CH4 分子的比例模型: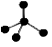 D.-CH3(甲基)的电子式为:
D.-CH3(甲基)的电子式为: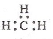
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com