
【题目】常温下,向20.00mL 0.200 0 mol/LNH4Cl溶液中逐滴加入0.2000 mol/LNaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。下列说法正确的是
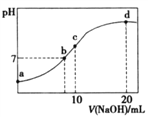
A. a点溶液中:c(H+)+c(NH3·H2O)=c(OH-)+c(NH4+)
B. b点溶液中:c(Cl-)=c(Na+)>c(H+)=c(OH-)
C. c点溶液中:c(NH3·H2O)+ c(NH4+)= c(Cl-)+ c(OH-)
D. d点溶液中:c(Cl-)> c(NH3·H2O)> c(OH-)> c(NH4+)
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】化合物F是合成一种天然茋类化合物的重要中间体,其合成路线如下:
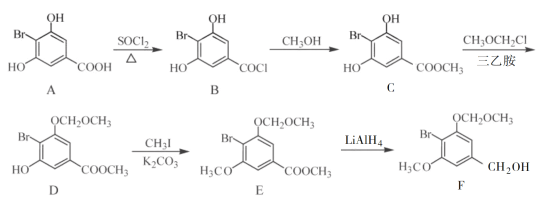
(1)E中含氧官能团的名称为________和________。
(2)B→C的反应类型为________。
(3)C→D反应中会有副产物X(分子式为C12H15O6Br)生成,X的结构简式为:________。反应D→E的方程式为______________。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
①能与FeCl3溶液发生显色反应;
②碱性水解后酸化,含苯环的产物分子中不同化学环境的氢原子数目比为1∶1。
(5)已知: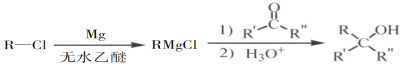 (R表示烃基,R'和R"表示烃基或氢),写出以
(R表示烃基,R'和R"表示烃基或氢),写出以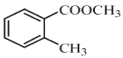 和CH3CH2CH2OH为原料制备的
和CH3CH2CH2OH为原料制备的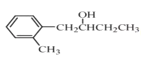 合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。____________________
合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室经常用KMnO4与过量浓盐酸反应制备氯气,化学方程式如下:2KMnO4 + 16HCl(浓) = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O。
(1)用单线桥标出电子转移的方向和数目:__________。
(2)将此反应改写为离子方程式:___________________。
(3)若31.6g KMnO4与过量浓盐酸充分反应,被氧化的HCl的物质的量为_____,在标准状况下生成的Cl 2的体积为____。
(4)用生成的氯气通入下面的装置来验证氯气的某些性质。
用离子方程式解释C中有色布条褪色的原因:______________,将B、C的顺序颠倒,可否达到原来的实验目的:______(填“可以”或“不可以”);D是用来检验氯气性质的实验,可观察到溶液由无色变为蓝色(I2单质遇淀粉变蓝色),请比较Cl2、I2 、KMnO4 的氧化性,由强到弱为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2.
已知该反应中H2O2只发生如下过程:H2O2―→O2.
①该反应中的还原剂是____________.
②该反应中,发生还原反应的过程是____________→____________.
③写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目_______
④如反应转移了0.3 mol电子,则产生的气体在标准状况下体积为____________
(Ⅱ)已知实验室利用KMnO4溶液和浓盐酸反应制取Cl2,请回答下列问题:
①配平此化学方程式:
____KMnO4+____HCl(浓)— ____KCl+____MnCl2+____Cl2↑+____H2O
②把此化学方程式改写成离子方程式: ________
③被氧化的HCl 与未被氧化的HCl物质的量之比为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是( )
A.0.1 mol N2的质量是2.8 g
B.常温常压下,22 g CO2中所含氧原子数约为6.02×1023
C.2 L 0.1mol·L-1NaCl溶液中,c(Na+)=0.2mol·L-1
D.标准状况下,11.2 L O2含有的原子数目约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些氮的化合物是引起大气污染、水体污染和土壤污染原因之一。
I.汽车和工业废气中的氮氧化物是城市空气污染的主要来源。氮氧化物处理通常有下列途径:
(1)在汽车排气管内安装催化转化器,其反应为2NO(g) +2CO(g)= 2CO2(g) +N2(g)。
①该反应能够正向自发进行,则正反应的ΔH_________0(填“>”或“<”)。
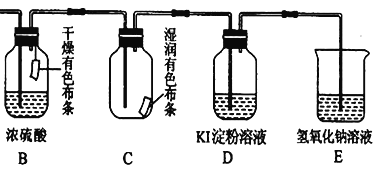
②根据传感器记录某温度下,NO、CO的反应进程,测量所得数据绘制出图1。前1s内平均反应速率v(N2)=__________mol/(L·s);第2s时的X值范围_________________________。
(2)烟气中的氮氧化物(NOx)可与甲烷在一定条件下反应转化为无害成分,从而消除污染。已知
反应 | 反应热(△H/kJ·mol-1) | 平衡常数(K) |
CH4(g)+2O2(g)═CO2(g)+2H2O(l) | a | K1 |
N2(g)+O2(g)═2NO(g) | b | K2 |
则CH4脱硝的热化学方程式为CH4(g) + 4NO (g)![]() CO2(g) + 2N2(g) + 2H2O (l)ΔH=_________kJ/mol(用a、b表示);平衡常数K3=_________(用K1、K2表示)。
CO2(g) + 2N2(g) + 2H2O (l)ΔH=_________kJ/mol(用a、b表示);平衡常数K3=_________(用K1、K2表示)。
II.氰化钠是一种重要的基本化工原料。“天津港”爆炸中,氰化钠产生泄漏,为了避免给土壤和水体带来污染,消防员通过喷洒双氧水来处理泄漏的氰化钠。
(3)已知:NaCN + H2O2+ H2O=NaHCO3+ NH3↑,用H2O2处理1mol NaCN时,反应中转移电子的物质的量为_________mol(NaCN中C为+2价)。
(4)某兴趣小组检测处理后的氰化钠废水是否达标。
已知:①废水中氰化钠的最高排放标准为0.50 mg/L。
②Ag++2CN-= [Ag(CN)2]-,Ag++I-= AgI↓,AgI呈黄色,且CN-优先与Ag+反应。
③实验如下:取30.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.000×10-4mol/L的AgNO3标准溶液滴定,消耗AgNO3溶液的体积为1.50 mL。
④滴定终点的判断方法是_________。
⑤经计算处理后的废水中NaCN的浓度为_________mg/L(保留两位小数),处理后的废水是否达到排放标准:________(填“是”或“否”)
III.工业废水中,含有NaNO2。NaNO2固体外观酷似食盐,误食会中毒。可用电解法将废水中少量的![]() 转化为N2以降低其危害。写出
转化为N2以降低其危害。写出![]() 在酸性条件下转化为氮气的电极反应式为_____________。
在酸性条件下转化为氮气的电极反应式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
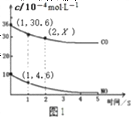
【题目】一氯化硫(S2Cl2)是一种重要的有机合成氯化剂,实验室和工业上都可以用纯净干燥的氯气与二硫化碳反应来制取(CS2+3Cl2![]() CCl4+S2Cl2),其装置如下:
CCl4+S2Cl2),其装置如下:
(1)A装置中的离子反应方程式为______________。
(2) 一氯化硫(S2Cl2)常温下较为稳定,受热易分解,易被氧化,且遇水即歧化,歧化产物中不仅有淡黄色固体,而且还有两种气体,用NaOH溶液吸收该气体可得两种盐Na2SO3和NaCl。 写出一氯化硫与水反应的化学反应方程式______________。
(3)B装置的作用是___________________________________。
(4)D中冷凝管的冷水进水口为____(填“a”或“b”);实验过程中,需要先点燃A处酒精灯,通入氯气一段时间后方可向D中水槽里面加入热水加热,这样做的目的是______________。
(5)F装置是用来处理尾气氯气的,已知该吸收反应的氧化产物不仅有NaClO还有NaClO3,且n(NaClO)/n(NaClO3)=3/1,则该反应被还原的氯原子与被氧化的氯原子物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子晶体的数据大小比较不正确的是
A. 熔点:NaF>MgF2>AlF3B. 晶格能:NaF>NaCl>NaBr
C. 阴离子的配位数:CsCl>NaClD. 硬度:MgO>CaO>BaO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用2.0 mol/L NaCl溶液配制100mL 0.10 mol/L NaCl溶液。
(1)计算:配制上述溶液,需要2.0 mol/L NaCl溶液_____________mL;
(2)称量:用量筒正确量取所需溶液;
(3)溶解:所需仪器是_____________、_____________;
(4)转移:将烧杯中的溶液沿着玻璃棒小心引流到___________________中;
(5)洗涤:将烧杯和玻璃棒洗涤2~3次并将洗涤液也都注入容量瓶中;
(6)定容:往容量瓶中加蒸馏水至距刻度线_________cm处,改用__________________加蒸馏水至液面与刻度线相切。盖好瓶塞摇匀;
(7)配制过程中出现以下情况,对所配溶液浓度有何影响(填偏高、偏低、不变):
①没有洗涤烧杯和玻璃棒_____________;
②量取2.0 mol/L NaCl溶液时俯视量筒的刻度线_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com