
| A. | 金属元素和非金属元素交界处最容易找到制催化剂的材料 | |
| B. | 电能是现代社会中应用最广泛、最方便的一次能源 | |
| C. | 太阳能电池的主要材料是高纯度的二氧化硅 | |
| D. | 煤块粉碎为煤粉的目的是提高煤的燃烧效率 |
分析 A.在过渡元素区寻找催化剂;
B.电能不能在自然界直接获得;
C.Si为常见的半导体材料;
D.增大接触面积,反应速率加快.
解答 解:A.在过渡元素区寻找催化剂,则金属元素和非金属元素交界处最容易找到半导体材料,故A错误;
B.电能不能在自然界直接获得,则电能是现代社会中应用最广泛、最方便的二次能源,故B错误;
C.Si为常见的半导体材料,则太阳能电池的主要材料是高纯度的硅,故C错误;
D.增大接触面积,反应速率加快,则煤块粉碎为煤粉的目的是提高煤的燃烧效率,故D正确;
故选D.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素的位置、性质、反应速率等为解答的关键,侧重分析与应用能力的考查,注意元素周期表的指导作用,题目难度不大.


科目:高中化学 来源: 题型:解答题
 如图为相互串联的甲乙两电解池.试回答:
如图为相互串联的甲乙两电解池.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正、逆反应的速率相等且不为0 | B. | 反应体系中的气体压强保持不变 | ||
| C. | 正、逆反应都还在继续进行 | D. | 反应混合物中各组分的浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯与苯都能使溴水褪色,但褪色原理不同 | |
| B. | 1mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气5mol | |
| C. | 溴水遇到乙醛溶液出现褪色现象,是因为它们发生了氧化还原反应 | |
| D. | 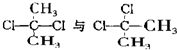 关系为同分异构体 关系为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
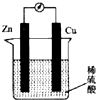
| A. | 锌为负极.锏为正极 | |
| B. | 铜片上有大童气泡生成 | |
| C. | 电流由锌片经导线流向铜片 | |
| D. | 当反应过程中有0.2 mol电子发生转移时,生成了 2.24 L氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
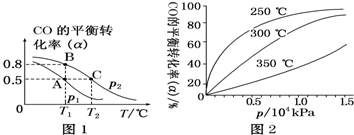 煤的气化可以减少环境污染,而且生成的CO和H2被称作合成气,能合成很多基础有机化工原料.
煤的气化可以减少环境污染,而且生成的CO和H2被称作合成气,能合成很多基础有机化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
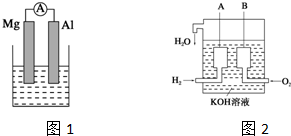
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上第二次模拟化学试卷(解析版) 题型:选择题
常温下,用0.05mol•L﹣1 KOH溶液滴定 10.00mL0.05mol•L﹣1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(体积变化忽略不计).下列说法正确的是( )

A.点②溶液中:c(K+)+c(H+)=c(HC2O4﹣)+c(C2O42﹣)+c(OH﹣)
B.点③溶液中:c(K+)=c(HC2O4﹣)+c(C2O42﹣)+2c(H2C2O4)
C.点④溶液中:c(K+)+c(H2C2O4)+c(HC2O4﹣)+c(C2O42﹣)=0.05 mol•L﹣1
D.点⑤溶液中:c(K+)>c(HC2O4﹣)>c(C2O42﹣)>c(OH﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上第一次月考化学卷(解析版) 题型:选择题
完成下列实验所需选择的装置或仪器都正确的是 ( )
| A | B | C | D |
实验 | 分离植物油和氯化钠溶液 | 除去氯化钠晶体中混有的硝酸钾晶体 | 分离CCl4中的I2 | 除去CO2气体中的HCl气体 |
装置 |
|
|
|
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com