
| A. | ①②③ | B. | ③④⑤ | C. | ②④⑤ | D. | ①③⑤ |
分析 ①依据同主族元素从上到下金属性依次增强解答;
②钾氧化物存在KO2;
③依据碱金属性质活泼,易于空气中的水、二氧化碳反应解答;
④碱金属密度从Li-Cs 次递减趋势;
⑤依据原子半径大小比较规律:电子层越多半径越大解答.
解答 解:①Li、Na、K、Rb、Cs属于碱金属元素从上到下金属性依次增强,所以金属性最强的是铯,故①正确;
②钾氧化物存在KO2,故②错误;
③碱金属性质活泼,易于空气中的水、二氧化碳反应,在自然界中均以化合态形式存在,故③正确;
④碱金属密度从Li-Cs 次递减趋势,故④错误;
⑤电子层不同的,一般电子层越大半径越大,所以Rb+、K+、Na+,电子层依次减少,所以半径Rb+>K+>Na+,故⑤正确;
故选:D.
点评 本题考查了碱金属的性质,掌握同主族元素性质的递变规律即可解答,题目难度不大,侧重于考查学生对基础知识的应用能力.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释 |
| A | 在密闭容器中加热CuO制1000℃ | 黑色固体变成红色固体 | CuO受热分解得到单质Cu |
| B | 将SO2通入品红溶液中 | 溶液褪色 | SO2具有漂白性 |
| C | 将Mg、Al与NaOH溶液组成原电池 | Al电极溶解 | Al比Mg金属活动性强 |
| D | 向某溶液中加入盐酸酸化的氯化钡溶液 | 有白色沉淀生成 | 该溶液中一定含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应证明了,含最高价元素的化合物,一定具有强氧化性 | |
| B. | 1mol还原剂反应时,转移的电子数为2NA | |
| C. | H2SO4在反应中表现了氧化性和酸性 | |
| D. | 可以利用该反应原理,将它设计成原电池,通过检测电流强度判断司机是否饮酒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如表所示:
纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如表所示:| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
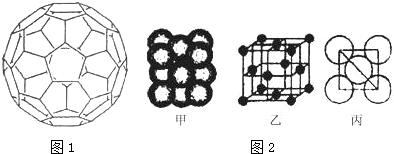
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2-→CH3Cl+HCI | |
| B. | CH2═CH2+Br2-→CH2BrCH2Br | |
| C. | nCH2═CH2-→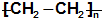 | |
| D. | CH3CH2OH+CH3COOH-→CH3COOCH2CH3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子百分数 | |
| B. | 有气体参加的化学反应若增大压强(即缩小反应容器的体积),可增加反应物分子中活化分子的百分数从而使反应速率增大 | |
| C. | 增大反应物浓度可增大单位体积内活化分子的百分数,从而使有效碰撞次数增加 | |
| D. | 催化剂不影响反应的活化能,但能增大单位体积内活化分子百分数,增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
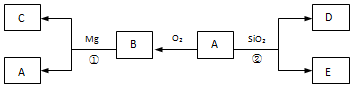
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com