

| 时间/s | 1 | 2 | 3 | 4 | 5 | |
| c(NO) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(NO) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
 v (NO)=
v (NO)= ×
× =1.42×10-4mol?L-1?s-1
=1.42×10-4mol?L-1?s-1 △c(NO)=
△c(NO)= ×(10.0×10-4 mol?L-1-1.00×10-4 mol?L-1)=4.50×10-4 mol?L-1
×(10.0×10-4 mol?L-1-1.00×10-4 mol?L-1)=4.50×10-4 mol?L-1 =
= =5000L?mol-1.
=5000L?mol-1.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解

| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(×10-4mol?L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(NO)(×10-3mol?L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

 CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.
CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.
| ||
| ||
| ||
 CO+3H2
CO+3H2 CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如上左图所示.
CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如上左图所示.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
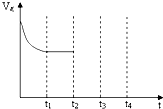 目前,全国多个地区为雾霾所困,氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
目前,全国多个地区为雾霾所困,氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com