
 短周期元素A、B、C、D的位置如图所示,B、C两元素的原子序数之和是A元素的4倍,各元素对应的物质相互比较,其中关系正确的是( )
短周期元素A、B、C、D的位置如图所示,B、C两元素的原子序数之和是A元素的4倍,各元素对应的物质相互比较,其中关系正确的是( )| A、原子半径:C>D>A |
| B、单质的熔点:B>C;D>A |
| C、最高正价:B>D=A>C |
| D、气态氢化物的稳定性:B>C,D>A |


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
 已知I、II反应在一定条件节焓变及平衡常数如下:
已知I、II反应在一定条件节焓变及平衡常数如下:查看答案和解析>>
科目:高中化学 来源: 题型:
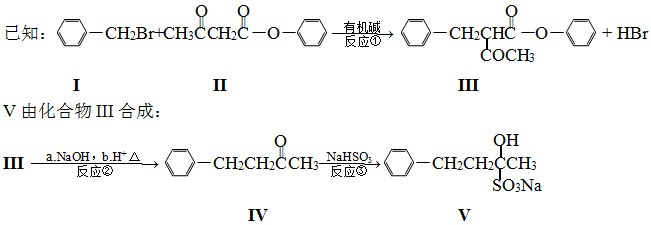
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组的同学通过以下实验确定炭粉与Na2O2反应的产物.
某化学兴趣小组的同学通过以下实验确定炭粉与Na2O2反应的产物.
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制取氧气 |
| B、制取二氧化碳 |
| C、粗盐提纯 |
| D、用氯化钠晶体配制100g 5%的氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ①如图中,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压滴管胶头,使液体Y滴入瓶中,振荡,过一会可见小气球a鼓气.气体X和液体Y可能是(完成下列表格)
①如图中,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压滴管胶头,使液体Y滴入瓶中,振荡,过一会可见小气球a鼓气.气体X和液体Y可能是(完成下列表格)| 气体X | Cl2 | ||
| 液体Y | H2O | NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=6的某溶液 |
| B、加酚酞后显无色的溶液 |
| C、能与金属Al反应放出H2的溶液 |
| D、c(H+)>c(OH-)的任意水溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com