
在学习了化学反应速率知识后,某研究性学习小组进行了科学探究活动。
[探究活动一]探究金属与不同酸反应的反应速率:常温下,用经过砂纸打磨的铝片中取两片质量相等、表面积相同的铝片,分别加入到盛有体积相同、c(H+)相同,足量的稀硫酸和稀盐酸溶液的两支试管中,发现铝片在稀盐酸中消失的时间比在稀硫酸中短。
(1)对[探究活动一]实验现象发生的原因,请你帮该研究性学习小组提出两个假设:
假设Ⅰ_______________________________。
假设Ⅱ_______________________________。
并请你设计实验对以上假设进行验证:
验证假设Ⅰ_______________________________。
验证假设Ⅱ_______________________________。
[探究活动二]某小组在实验室测定氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率。
(2)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).
实验测得不同温度下的平衡数据列于下表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①可以判断该分解反应已经达到化学平衡状态的是 .
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数: .
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量 (填“增加”、“减小”或“不变”).
④氨基甲酸铵分解反应的焓变△H 0,熵变△S 0(填>、<或=).
(3)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如下图所示.
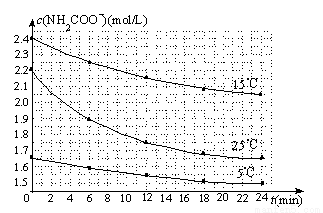
⑤计算25℃时,0~6min氨基甲酸铵水解反应的平均速率: .
⑥根据图中信息,如何说明水解反应速率随温度升高而增大: 。
科目:高中化学 来源:2016-2017学年广西省高二上9月月考化学试卷(解析版) 题型:选择题
25℃、101kPa条件下,反应2N2O5 (g)=4NO2 (g)+O2(g) △H=+56.7kJ/mol能自发进行的原因( )
A.吸热反应 B.放热反应
C.熵减小的反应 D.熵增效应大于热效应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏高二上学期期中化学卷(解析版) 题型:填空题
I.工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g) CH3OCH3(g)+3H2O(g) ΔH <0 温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产率将____________(填“变大”、“变小”或“不变”,下同),混合气体的平均相对分子质量将____________;
CH3OCH3(g)+3H2O(g) ΔH <0 温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产率将____________(填“变大”、“变小”或“不变”,下同),混合气体的平均相对分子质量将____________;
Ⅱ.某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应 4NO2(g)+O2(g)  2N2O5(g) ΔH <0的影响。
2N2O5(g) ΔH <0的影响。

(1)图像中T1和T2的关系是T1________T2(填“>”、“<”或“=”);
(2)比较a、b、c三点所处的平衡状态中,反应物NO2的转化率最大的是________(填字母);
(3)若起始时NO2是4mol,容器体积为1 L,n=1 mol,NO2的转化率为50%,则此条件下(T2),反应的平衡常数为_________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏高二上学期期中化学卷(解析版) 题型:选择题
在密闭容器里,A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)表示,已知3v(B)=2v(A)、2v(C)=3v(B),则此反应可 表示为
表示为
A.2A+3B = 2C B.A+3B = 2C C.3A+2B = 3C D.A+B = C
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏高二上学期期中化学卷(解析版) 题型:选择题
下列反应既是氧化还原反应,又是吸热反应的是
A.灼热的炭与CO2反应 B.铝片与稀H2SO4反应
C.Ba(OH)2·8H2O与NH4Cl的反应 D.甲烷在O2中的燃烧反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年内蒙古高二上10月月考化学卷(解析版) 题型:选择题
室温下,将1.000mol/L盐酸滴入20.00mL 1.000mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是
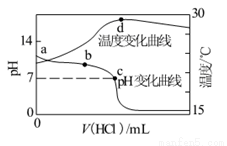
A.a点由水电离出的c(H+)=1.0×10-14mol•L-1
B.b点:c(NH4+)+c(NH3•H2O)=c(Cl-)
C.c点:c(Cl-)=c(NH4+)
D.d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热
查看答案和解析>>
科目:高中化学 来源:2016-2017学年内蒙古高二上10月月考化学卷(解析版) 题型:选择题
对于等物质的量浓度的Na2CO3和NaHCO3溶液,下列说法不正确的是
A.分别升高温度,两种溶液的pH均减小
B.相同温度下两种溶液的pH:Na2CO3> NaHCO3
C.分别加入少量NaOH,两溶液中c(CO32-)均增大
D.两溶液均存在c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上月考一化学试卷(解析版) 题型:选择题
在298K、1.01×10 5Pa下,将22gCO2通入750mLl mol./LNaOH溶液中充分反应,测得反应放出xkJ的热量。己知在该条件下,1molCO2通入lL2mol ·L-1NaOH溶液中充分反应放出y kJ的热量,则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是
A. CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(2y-x)kJ·mol-l
B. CO2(g)+NaOH(aq)=NaHCO3(aq) △H =-(2x-y) kJ·mol-l
C. CO2(g)+NaOH(aq)=NaHCO3(aq) △H =-(4x-y) kJ·mol-l
D. CO2(g)+NaOH(l)=NaHCO3(l) △H =-(4x-y) kJ·mol-l
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西大学附中高一上10月模块诊断化学卷(解析版) 题型:选择题
①漏斗 ②试管 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥研钵
A. ①③④ B. ①②⑥ C. ①③⑤ D. ①③⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com