
下列关于物质分类的说法正确的是( )
A.化合反应均为氧化还原反应
B.液氨、液氯、液体氯化氢都是非电解质
C.多糖、油脂、蛋白质都是高分子化合物
D.古代的陶瓷、砖瓦,现代的玻璃、水泥等,都是硅酸盐产品
科目:高中化学 来源: 题型:
氯气用途十分广泛,可用于生产半导体材料硅,其生产的流程如下,下列说法不正确的是( )




A.①、③是置换反应,②是化合反应
B.高温下,焦炭与氢气的还原性均强于硅
C.任一反应中,每消耗或生成28 g硅,均转移4 mol电子
D.高温下将石英砂、焦炭、氯气、氢气按一定比例混合可得高纯硅
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述不能体现“化学让生活更美好”这一主旨的是( )
A.风力发电,让能源更清洁
B.合成塑料,让材料更丰富
C.合成药物,让人类更健康
D.环保涂料,让环境更宜居
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是
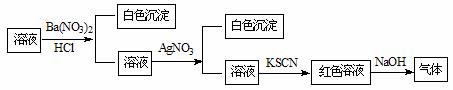
A.原溶液中一定含有SO42-离子 B.原溶液中一定含有NH4+离子
C.原溶液中一定含有Cl-离子 D.原溶液中一定含有Fe3+离子
查看答案和解析>>
科目:高中化学 来源: 题型:
某纯碱样品中含有少量氯化钠杂质,为了测定此样品纯度,甲同学设计了下图所示装置和实验方案。实验步骤如下:
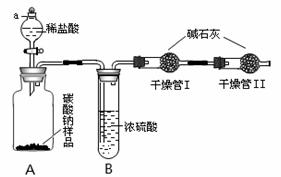
①按图将仪器组装好并检查气密性;
②准确称量盛有碱石灰的干燥管Ⅰ的质量(设为m1);③准确称量纯碱样品的质量(设为n),放入广口瓶A内;④打开分液漏斗a的旋塞,缓缓滴入稀盐酸,至不再产生气泡为止;
⑤称量干燥管Ⅰ的质量(设为m2)。
(1)实验操作④要缓缓地进行,其理由是________________。如果操作太快,会导致测定结果________(填偏大、偏小或不变)。
(2)装置B的作用是_____________________;干燥管Ⅱ的作用是_________________。
(3)根据甲同学的实验数据,写出计算纯碱样品纯度的公式_______________________
(4)方案评价:乙同学认为甲同学的方案有缺陷。乙同学认为稀盐酸要改为稀硫酸,否则会导致测定结果偏大。你认为还有其它缺陷吗?如果有,提出你的改进意见或需要添加的实验步骤,并指出甲同学缺少这一步骤会对结果产生什么影响(填偏大、偏小或不变),将答案填入表中(不一定要填满)。
| 序号 | 改进意见 | 缺少时的影响 |
| ① | ||
| ② | ||
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
向物质的量相等的硫酸铝和硫酸铵溶于水形成的混合溶液中逐滴加入氢氧化钠溶液直至过量。下列表示氢氧化钠溶液加入的体积(X)与溶液中沉淀的量(Y)的关系示意图中正确的是( )
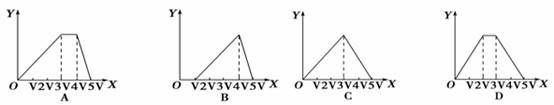
查看答案和解析>>
科目:高中化学 来源: 题型:
1.52g铜镁合金完全溶解于50mL密
度为1.40g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。
(1)该合金中铜与镁的物质的量之比是 。
(2)NO2和N2O4的混合气体中,NO2的体积分数是 。
(3)得到2.54 g沉淀时,加入NaOH溶液的体积是 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F、G为原子序数依次递增的7种短周期主族元素。A、B元素的最高正价与最低负价的代数和均为零;C元素是植物生长三大营养元素之一;D的单质具有强氧化性,其氢化物能和一种半导体材料反应生成常温常压下的两种气体;E原子核外K层电子数与M层电子数相等;F原子的价电子数等于电子层数的两倍。请回答下列问题:
(1)CD3 的电子式为 ;
(2)用离子方程式表示G 的非金属性比F强 ;
(3)EF在空气中充分灼烧生成一种稳定性的盐,则此反应方程式为 ;
(4)C的氢化物与G的单质以物质的量之比1:3反应,生成二元化合物X和一种气体,该气体遇氨气产生“白烟”,则X的化学是为 ,X与水反应的产物名称是
;
(5)已知充分燃烧一定量的B2A2放出Q kJ的能量,燃烧生成的产物恰好与100ml 5 mol·L-1的NaOH溶液完全反应生成正盐,则燃烧1mol B2A2放出的热量为 KJ;
(6)常温下,E(OH)2在水中的沉淀溶解平衡曲线如图所示(单位mol·L-1)。要使c(E2+) 为0.001 mol·L-1的溶液形成沉淀,则溶液的PH值至少升高到 。


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com