
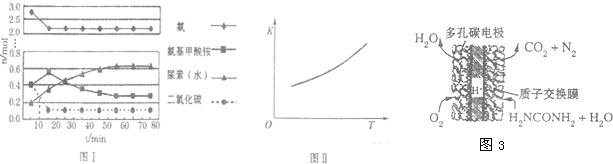
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平均总压强/KPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平均气体总浓度/10-3mol?L-1 | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
| 1 |
| 3 |
| 2 |
| 3 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、与金属铝反应能放出氢气的溶液:NH4+、NO3-、CO32-、Na+ |
| B、无色澄清溶液:K+、NO3-、SO42-、Fe3+ |
| C、能使pH试纸变红的溶液:NH4+、Na+、SO42-、Fe3+ |
| D、水电离产生的c(H+)=1×10-12mol/L的溶液:HCO3-、NH4+、Cl-、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④ | B、①②③ |
| C、①③ | D、①② |
查看答案和解析>>
科目:高中化学 来源: 题型:
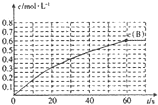 298K时,某容积固定为1L的密闭容器中发生如下可逆反应:A(g)?2B(g);
298K时,某容积固定为1L的密闭容器中发生如下可逆反应:A(g)?2B(g);| 1 |
| 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
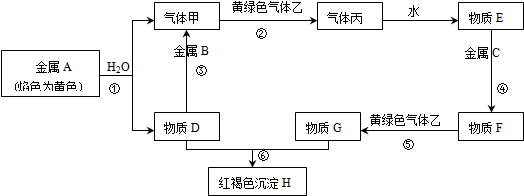
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg为电池的正极 |
| B、负极反应为AgCl+e-=Ag+Cl- |
| C、不能被KCl 溶液激活 |
| D、可用于海上应急照明供电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
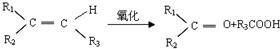 则符合上述条件的烃A有( ) 种(考虑顺反异构).
则符合上述条件的烃A有( ) 种(考虑顺反异构).| A、3 | B、4 | C、6 | D、8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该过程中氧化剂与还原剂的物质的量之比为1:8 |
| B、该过程说明Fe(NO3)2溶液不宜加酸酸化 |
| C、若有1mol NO3-发生氧化反应,则转移8mol e- |
| D、反应的过程中酸性减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com