
| A. | 明矾可作净水剂:Al3++3H2O=Al(OH)3↓+3H+ | |
| B. | 盛装NaOH溶液的试剂瓶不用玻璃塞:SiO2+2NaOH=Na2SiO3+H2O | |
| C. | NaHCO3溶液中加入少量Ca(OH)2溶液,产生白色沉淀:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 电解NaCl溶液,阴极有无色气体逸出,其电极反应式为:2Cl--2e-=Cl2↑ |
分析 A.氢氧化铝胶体不应书写沉淀符号;
B.二氧化硅与氢氧化钠反应生成具有粘性的硅酸钠溶液;
C.氢氧化钙少量,反应生成碳酸钙、碳酸钠和水;
D.阴极发生还原反应,氢离子得到电子生成氢气.
解答 解:A.明矾可作净水剂,离子方程式:Al3++3H2O=Al(OH)3+3H+,故A错误;
B.盛装NaOH溶液的试剂瓶不用玻璃塞,离子方程式:SiO2+2NaOH=Na2SiO3+H2O,故B正确;
C.NaHCO3溶液中加入少量Ca(OH)2溶液,产生白色沉淀,离子方程式:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-,故C错误;
D.电解NaCl溶液,阴极有无色气体逸出,其电极反应式为:2H++2e-=H2↑,故D错误;
故选:B.
点评 本题考查了离子方程式、化学方程式、电极反应式的书写,明确发生反应是解题关键,注意电解池工作原理,题目难度不大.


科目:高中化学 来源: 题型:选择题
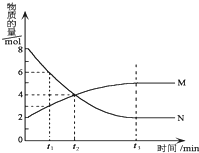 在一定温度下,在某密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示.下列叙述中,正确的是( )
在一定温度下,在某密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示.下列叙述中,正确的是( )| A. | 该反应的化学方程式为M═2N | |
| B. | 若t1=1,则反应开始至t1时间段M 的反应速率为1mol﹒L-1﹒min-1 | |
| C. | t2时正逆反应速率相等,反应达到平衡状态 | |
| D. | t3时正反应速率等于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径 C>D>B>A | B. | 原子序数 d>c>b>a | ||
| C. | 单质的活泼性 A>B,D>C | D. | 原子半径 A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
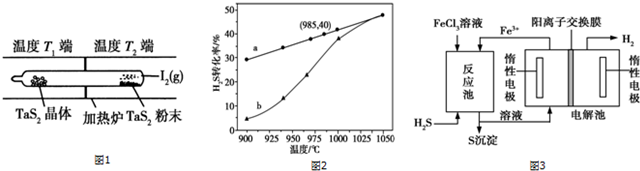
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
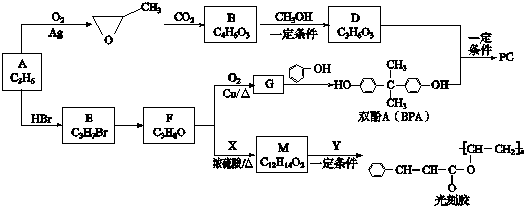
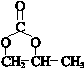 .
.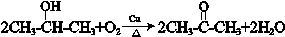 .
.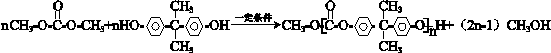 .
.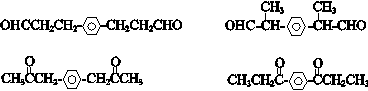 (其中一种).
(其中一种).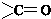 结构
结构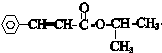 +
+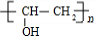 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$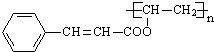 +nCH3CHOHCH3.
+nCH3CHOHCH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应A(g)?2B(g)△H,若正反应的活化能为Ea kJ/mol,逆反应的活化能为Eb kJ/mol,则△H=-( Ea-Eb)kJ/mol | |
| B. | 常温下,pH相同的NaOH溶液和Ba(OH)2溶液中,水的电离程度相同 | |
| C. | 某温度氯化钠在水中的溶解度是20 g,该温度饱和氯化钠溶液的质量分数为20% | |
| D. | 将浓度为0.1 mol/L HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,$\frac{c({F}^{-})}{c({H}^{+})}$始终保持增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
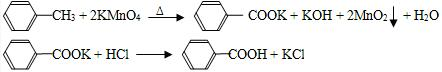
 ─CH3+6KMnO4→3
─CH3+6KMnO4→3 ─COOK+6MnO2+3KOH+3H2O
─COOK+6MnO2+3KOH+3H2O ─COOK+HCl→
─COOK+HCl→ ─COOH+KCl
─COOH+KCl| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |

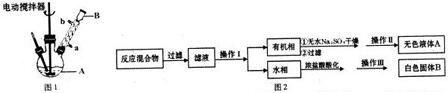
 ,操作Ⅱ为蒸馏.
,操作Ⅱ为蒸馏.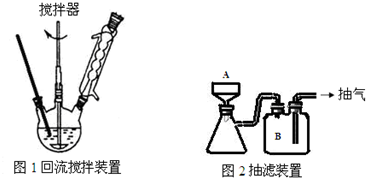
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com