
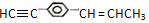 的说法正确的是( )
的说法正确的是( )| A. | 所有碳原子有可能都在同一平面上 | |
| B. | 最多只可能有9个碳原子在同一平面上 | |
| C. | 有7个碳原子可能在同一直线上 | |
| D. | 至少有6个碳原子在同一直线上 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F、Cl、Br、I最高正化合价都为+7 | |
| B. | 卤族元素的单质只有氧化性 | |
| C. | 从F到I,原子的得电子能力依次加强 | |
| D. | 卤素单质与H2化合的难易程度按F2、Cl2、Br2、I2的顺序由易变难 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下5.6L CH4含有的共用电子对数目为NA | |
| B. | 25℃时,pH=1的硫酸溶液中含有H+的数目为0.1NA | |
| C. | 常温下,23g NO2和N2O4混合气体中所含原子总数为1.5NA | |
| D. | 将0.5mol NH4NO3于稀氨水使溶液呈中性,溶液中NH4+数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ④⑥ | C. | ③⑥ | D. | ③⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 原子或分子相关信息 | 单质及其化合物相关信息 | |
| X | ZX4分子是由粗Z提纯Z的中间产物 | X的最高价氧化物对应的水化物为无机酸中最强酸 |
| Y | Y原子的最外层电子数等于电子层数 | Y的氧化物是典型的两性氧化物,可用于制造一种高温材料 |
| Z | Z原子的最外层电子数是次外层电子数的$\frac{1}{2}$ | Z广泛存在于无机非金属材料中,其单质是制取大规模集成电路的主要原料 |
| W | W原子的最外层电子数小于4 | W的常见化合价有+3、+2,WX3稀溶液呈黄色 |
 ;X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为6H++Al2O3=2Al3++3H2O.
;X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为6H++Al2O3=2Al3++3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水,产生黄绿色气体:2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$2NaOH+H2+Cl2 | |
| B. | 用Na2CO3溶液将水垢中的CaSO4转化为CaCO3:CO32-+Ca2+=CaCO3 | |
| C. | 向H202溶液中滴加CuSO4溶液,产生气泡:2H2O2 $\frac{\underline{\;CuSO_{4}\;}}{\;}$2H2O+O2 T | |
| D. | 向苯酚浊液中滴加Na2CO3溶液,溶液变澄清: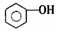 +CO32-→ +CO32-→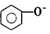 +HCO3- +HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2NA | |
| B. | 将1 mol Cl2通入水中,HC1O、Cl-、ClO-粒子数之和为2NA | |
| C. | 标准状况下,44.8L NO与22.4 L O2反应后的分子数是2NA | |
| D. | 27g铝中加入1mol/L的NaOH溶液,转移电子数是3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
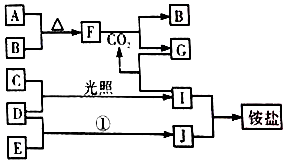 如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应
如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应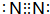 ,F
,F ;
; ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com