
某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中正确的是( )
A.肯定有SO2和NO B.可能有Cl2、O2和NO2
C.可能有Cl2和O2 D.肯定只有NO
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
在101kPa 25℃时,1.0g乙烷气体完全燃烧生成液态水时放出热量52.0kJ,则乙烷燃烧的热化学方程式为
A.C2H6(g) + 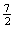 O2(g)=2CO2(g) +3H2O(l) △H =-1560kJ·mol-1
O2(g)=2CO2(g) +3H2O(l) △H =-1560kJ·mol-1
B.2C2H6(g) + 7O2(g)=4CO2(g) +6H2O(g) △H =-1560kJ·mol-1
C.2C2H6(g) + 7O2(g)=4CO2(g) +6H2O(l) △H =+3120 kJ·mol-1
D.C2H6(g) + O2(g)=2CO2(g) +3H2O(l) △H =-52.0kJ·mol-1
O2(g)=2CO2(g) +3H2O(l) △H =-52.0kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,0.1mol·L-1的某一元碱MOH溶液pH = 13,将它和某一元酸HA的溶液等体积混合,混合后的溶液恰好为中性。下列判断正确的是( )
A.HA溶液的pH一定为1 B.盐MA可能水解
C.HA物质的量浓度一定为0.1mol·L-1 D.混合后溶液中,c(M+)一定等于c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.实验室从海带提取单质碘的方法是:取样 灼烧 溶解 过滤 萃取
B.用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度
C.氯离子存在时,铝表面的氧化膜易被破坏,因此含盐腌制品不宜直接放在铝制容器中
D.将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生对SO2与漂粉精的反应进行实验探究:
| 操作 | 现象 |
| 取4 g漂粉精固体,加入100 mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
|
| ⅰ液面上方出现白雾; ⅱ稍后,出现浑浊,溶液变为黄绿色; ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是 2Cl2+2Ca(OH)2 CaCl2+Ca(ClO)2+2H2O 。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是 碱性、漂白性 。
(3)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
① 实验a的目的是 检查白雾中是否含有Cl2,排除Cl2干扰 。
②由实验a、b不能判断白雾中含有HCl,理由是 白雾中含有SO2,SO2可与酸化的AgNO3溶液反应产生白色沉淀 。
(4)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。通过进一步实验确认了这种可能性,其实验方案是________________________________________________________________________
________________________________________________________________________。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X。
①向沉淀X中加入稀HCl,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀。则沉淀X中含有的物质是 CaSO4 。
②用离子方程式解释现象ⅲ中黄绿色褪去的原因: Cl2+SO2+2H2O 4H++2Cl-+SO 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
相同质量的铜片分别与过量的体积相同的浓硝酸、稀硝酸反应。二者比较,相等的是( )www.21-cn-jy.com
①铜片消耗完所需时间 ②反应生成的气体体积(标准状况) ③反应中氧化剂得到的电子总数 ④反应后溶液中铜离子的浓度
A.①③ B.②④
C.③④ D.只有①
查看答案和解析>>
科目:高中化学 来源: 题型:
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为 5 。
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)===N2O4(l) ΔH1=-195kJ·mol-1
②N2H4(l)+O2(g)===N2(g)+2H2O(g) ΔH2=-534.2kJ·mol-1
写出肼和N2O4反应的热化学方程式________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(4)肼—空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略)
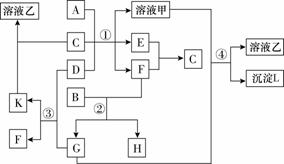
(1)A、B、C、D代表的物质分别为______、______、______、______(填化学式);
(2)反应①中的C、D均过量,该反应的化学方程式是
________________________________________________________________________
________________________________________________________________________;
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是 CO2 、 CO (填化学式);
(4)反应③产物中K的化学式为 Na2CO3 ;
(5)反应④的离子方程式为________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下将3 mol CO2和2 mol H2混合于2 L的密闭容器中,发生如下反应:CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
(1)该反应的化学平衡常数表达式K=__________。
(2)已知在700℃时,该反应的平衡常数K1=0.6,则该温度下反应CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K2=__________。
CO2(g)+H2(g)的平衡常数K2=__________。
(3)已知在1000℃时,该反应的平衡常数K3为1.0,则该反应为__________反应(填“吸热”或“放热”)。
(4)能判断该反应达到化学平衡状态的依据是__________________。
A.容器中压强不变 B.c(CO2)=c(CO) C.生成a mol CO2的同时消耗a mol H2 D.混合气体的平均相对分子质量不变
(5)在1000℃下,某时刻CO2的物质的量为2.0 mol,则此时v(正)______v(逆)
(填“>”、“=”或“<”)。该温度下反应达到平衡时,CO2的转化率为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com