
| A、吸热反应都需加热才能发生 |
| B、在铁制品上镀铜时,铁制品作阳极,铜盐溶液作电镀液 |
| C、应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D、密闭容器中进行的可逆反应,气体压强不发生变化时说明反应一定达到化学平衡状态 |


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
 W、Q、R、X、Y、Z六种元素的原子序数逐渐增大.已知W原子Is轨道上只有一个电子,Q、X原子p轨道的电子数分别为2和4,Z的原子序数为29,除Z外均为短周期主族元素,Y原子的价电子排布为(n+1)sn(n+1)pn.请回答下列问题:
W、Q、R、X、Y、Z六种元素的原子序数逐渐增大.已知W原子Is轨道上只有一个电子,Q、X原子p轨道的电子数分别为2和4,Z的原子序数为29,除Z外均为短周期主族元素,Y原子的价电子排布为(n+1)sn(n+1)pn.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛.
在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛.查看答案和解析>>
科目:高中化学 来源: 题型:
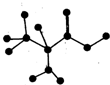 如图是某有机物分子中C、H、O、N四种原子的成键方式示意图(短线表示单键或者双键).下列关于该有机物的说法正确的是.
如图是某有机物分子中C、H、O、N四种原子的成键方式示意图(短线表示单键或者双键).下列关于该有机物的说法正确的是.| A、在一定条件下,可以通过聚合反应生成高分子化合物 |
| B、分子式为C3H6NO2 |
| C、能和NaOH溶液反应,但不能和盐酸溶液反应 |
| D、不能和NaHCO3溶液反应生成CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A,、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如图所示:
A,、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 用铂丝蘸取少量某无色溶液进行焰色反应 | 火焰呈黄色 | 该溶液一定是钠盐溶液 |
| B | 向滴有甲基橙的AgNO3溶液中滴加KCl溶液 | 溶液由红色变为黄色 | KCl溶液具有碱性 |
| C | 向溶液X中滴加稀盐酸 | 有气体产生 | 溶液X 中可能含有CO32- |
| D | 向含H2SO4的淀粉水解液中加入新制的Cu(OH)2,煮沸 | 没有砖红色沉淀 | 淀粉未水解 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生成1molNaNO3需消耗0.4molKMnO4 |
| B、反应过程中溶液的pH减小 |
| C、该反应中NO2-被还原 |
| D、X可以是盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com