
 2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右:
2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右: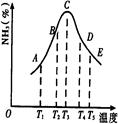
| A.升高温度 | B.降低温度 | C.增大压强 | D.减小压强 |
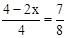 ,所以x=0.25mol。
,所以x=0.25mol。

科目:高中化学 来源:不详 题型:单选题
| A.1mol C2H2(g)完全燃烧生成气态水时放热大于1300kJ |
| B.1mol C6H6(1)完全燃烧生成液态水时放热大于3295kJ |
| C.相同条件下,等质量的C2H2(g)与C6H6(g)完全燃烧,C6H6(g)放热更多 |
| D.C2H2(g)三聚生成C6H6(g)的过程属于放热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.吸热88kJ | B.吸热2.44KJ | C.放热44kJ | D.吸热44KJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
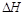 =______________。
=______________。 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H =-890kJ/mol |
B. CH4(g)+O2(g)= CH4(g)+O2(g)= CO2(g)+H2O(l) △H=-445kJ/mol CO2(g)+H2O(l) △H=-445kJ/mol |
C. CO2(g)+H2O(l)= CO2(g)+H2O(l)= CH4(g)+O2(g) △H= +445kJ/mol CH4(g)+O2(g) △H= +445kJ/mol |
| D.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H =-55.625kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g)△H=-92.0KJ·mol-1,将1mol N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为20%。若在相同条件下,起始时在该容器中充入2mol NH3,反应达到平衡时的热量变化是
2NH3(g)△H=-92.0KJ·mol-1,将1mol N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为20%。若在相同条件下,起始时在该容器中充入2mol NH3,反应达到平衡时的热量变化是| A.吸收18.4KJ热量 | B.放出73.6KJ热量 |
| C.放出18.4KJ热量 | D.吸收73.6KJ热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com