
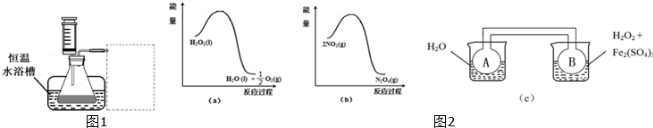
| 实验序号 物理量 | V[0.1mol?L-1 Fe2(SO4)3]/mL | … | |
| 1 | a | … | |
| 2 | a | … |
 ,
, ;
;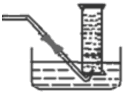 ,
, ;
;| 实验序号 | V[0.1mol?L-1 Fe2(SO4)3]/mL | V(30% H2O2)/mL | V(蒸馏水)/mL | 时间t/min | V(氧气)/mL |
| 1 | a | b | c | d | m |
| 2 | a | c | b | d | n |
| 实验序号 | V[0.1mol?L-1 Fe2(SO4)3]/mL | V(30% H2O2)/mL | V(蒸馏水)/mL | 时间t/min | V(氧气)/mL |
| 1 | a | b | c | d | m |
| 2 | a | c | b | d | n |


科目:高中化学 来源: 题型:

| A、装置Ⅰ可用于测定中和热 |
| B、装置Ⅱ装置放置一段时间后,饱和CuSO4溶液中不出现蓝色晶体 |
| C、装置Ⅲ中的石英坩埚可用于熔化氢氧化钠 |
| D、装置Ⅳ可用于吸收易溶于水的尾气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、84g NaHCO3晶体中含有NA个CO32- |
| B、0.1mol?L-1K2CO3溶液中,阴离子总数大于0.1NA |
| C、1.8g石墨和C60的混合物中,碳原子数目为0.15NA |
| D、标准状况下,22.4L CCl4中含有的共用电子对数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向稀盐酸中加入少量钠粒:2Na+2H2O═2Na++2OH-+H2↑ |
| B、向氯化铁溶液中滴加偏铝酸钠溶液:Fe3++3AlO2-+6H2O═Fe(OH)3↓+3Al(OH)3↓ |
| C、用漂白粉溶液吸收尾气中SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
| D、向含氯化铝的氯化镁溶液中加入氧化镁:Al3++MgO+H2O═Al(OH)3↓+Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将少量SO2气体通入NaClO溶液中SO2+2ClO-+H2O═SO32-+2HClO |
| B、苯酚钠溶液中通入少量的二氧化碳气体C6H5O-+CO2+H2O═C6H5OH+HCO3- |
| C、足量的溴化亚铁溶液和少量的氯气反应2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
| D、向氯化铝溶液中加入过量的氨水Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 在一定温度下,4L密闭容器内M、N两种物质随时间变化的曲线如图所示:
在一定温度下,4L密闭容器内M、N两种物质随时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
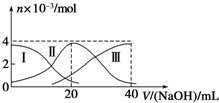 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示.根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示.根据图示判断,下列说法正确的是( )| A、当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-) |
| B、等浓度的NaOH溶液与H2A溶液按2:1混合后,其溶液中水的电离程度比纯水大 |
| C、NaHA溶液中:c(OH-)=c(H+)+c(HA-)+2c(H2A) |
| D、向上述加入20mL NaOH溶液后所得溶液中再加入水的过程中,pH可能减少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com