
精细化工在生产和生活中有广泛而重要的应用。
(1)精细化学品往往有特定的功能从而广泛地应用于日常生活中,下列洗涤方法原理各不相同,请比较分析:
沾有油脂的器皿可用汽油擦洗,其原理是____________________________;也可用洗洁精和水洗涤,其原理是__________________________;还可以用纯碱或稀氢氧化钠溶液洗涤,其原理是____________________________________。如果水溶液的硬度很大,用肥皂与合成洗涤剂哪个洗涤剂效果更好?为什么? ________________________。
(2)据报道,我国某地发生误食工业用猪油的中毒事件,原因是工业品包装中混入有机锡等,下列有关叙述正确的是__________。
A.猪油是天然高分子化合物
B.猪油是高级脂肪酸甘油酯
C.猪油发生皂化反应后,反应液能使蓝色石蕊试纸变红
D.猪油皂化反应完全后,反应混合物静置后分为两层
(3)阿司匹林是一种常用的药剂,其化学名称为乙酰水杨酸,其分子结构如图: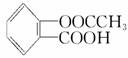 阿司匹林的一种同分异构体中含有苯环和两个羧基,且苯环上只有一个侧链,则阿司匹林的这种同分异构体的结构简式为____________。以苯酚为原料合成水杨酸,为阿司匹林的大量生产开辟了广阔的前景,其生产阿司匹林的流程如下:
阿司匹林的一种同分异构体中含有苯环和两个羧基,且苯环上只有一个侧链,则阿司匹林的这种同分异构体的结构简式为____________。以苯酚为原料合成水杨酸,为阿司匹林的大量生产开辟了广阔的前景,其生产阿司匹林的流程如下: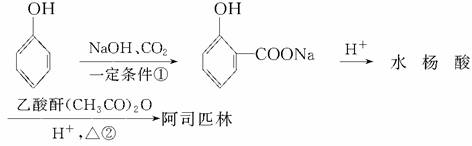
写出反应②的化学方程式___________________________________________。
 英才计划期末调研系列答案
英才计划期末调研系列答案 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:
把一块镁铝合金投入到1 mol/L HC1溶液里,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积
变化的关系如下图所示。下列说法中错误的是
A.HCl溶液的体积为80 mL
B.a的取值范围为0≤a<50
C.当a值为30时,b值为0.01
D.当a值为10时,b值为0.03
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W为周期表中前20号元素中的四种,原子序数依次增大,W、Y为金属元素,X原子的最外层电子数是次外层电子数的3倍,Y、Z位于同周期,Z单质是一种良好的半导体。W能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等。下列说法正确的是
A.原子半径:W>Y>Z>X
B.气态氢化物的稳定性:X<Z
C.最高价氧化物对应水化物的碱性:Y>W
D.Y、Z的氧化物都有酸性和碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
,实验室合成环己烯的反应和实验装置如下:

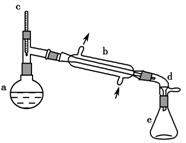
可能用到的有关数据如下:
| 相对分子质量 |
| 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5 %碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是________________。
(2)加入碎瓷片的作用是______________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是______(填正确答案标号)。
A.立即补加 B.冷却后补加
C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为________________。
(4)分液漏斗在使用前须清洗干净并________;在本实验分离过程中,产物应该从分液漏斗的________(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是________________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________(填正确答案标号)。
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是________(填正确答案标号)。
A.41% B.50%
C.61% D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
合成洗涤剂同肥皂相比有哪些优点:①原料便宜 ②不受软水、硬水的限制 ③不污染水体 ④去污能力强,你认为正确的是 ( )。
A.①②④ B.②③④ C.①④ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关硫元素及其化合物的说法或描述正确的是 ( )。
A.由硫黄制备硫酸经历两步:S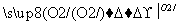 SO3
SO3 H2SO4
H2SO4
B.酸雨与土壤中的金属氧化物反应后,硫元素以单质的形式进入土壤中
C.在燃煤中加入石灰石可减少SO2排放,发生的反应为2CaCO3+2SO2+O2 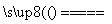 2CO2+2CaSO4
2CO2+2CaSO4
D.土壤中的闪锌矿(ZnS)遇到硫酸铜溶液转化为铜蓝(CuS),说明CuS很稳定,不具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中硫元素为-1价)在高温下和氧气反应制备SO2:4FeS2+11O2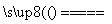 8SO2+2Fe2O3,该反应中被氧化的元素是________(填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为________ L。
8SO2+2Fe2O3,该反应中被氧化的元素是________(填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为________ L。
(2)实验室中用下列装置测定SO2催化氧化为SO3的转化率。(已知SO3的熔点为16.8 ℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响)
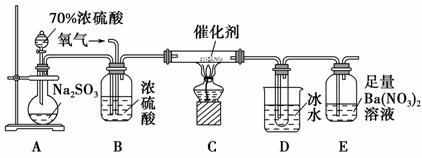
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作:________________________________________。
②实验过程中,需要通入氧气。试写出一个用如下图所示装置制取氧气的化学方程式:______________________________________。

③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是___________________________________________________________。
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是________(用含字母的代数式表示,不用化简)。
(3)某学习小组设计用如图装置验证二氧化硫的化学性质。
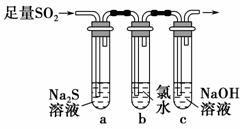
①能说明二氧化硫具有氧化性的实验现象为_______________________ ________________________________________________________。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验。
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀
上述方案中合理的是________(填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com