
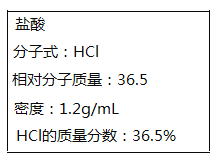
【题目】如图所示为实验室某浓盐酸试剂瓶上标签的有关内容。取该盐酸10mL,加蒸馏水稀释至250mL,向其中加入mg锌粉恰好完全反应。
(1)写出锌粉与盐酸反应的离子方程式______________。
(2)求原浓盐酸的物质的量浓度c=____________。
(3)计算出m=___________。
(4)反应中生成的H2可以和标准状况下______mL的O2恰好完全反应。
(5)向反应后的溶液中加入0.6mol/L的AgNO3溶液至不再产生沉淀,共消耗VmL AgNO3溶液,则V的值是__________。
【答案】Zn+2H+=Zn2++H2↑ 12mol/L 3.9 672 200
【解析】
(1)锌为活泼金属,锌与稀硫酸反应生成硫酸锌和氢气,反应的离子方程式为:Zn+2H+=Zn2++H2↑,故答案为:Zn+2H+=Zn2++H2↑。
(2)根据公式c=1000ρw/M,可得该浓盐酸的物质的量浓度为(1000×1.2×36.5%)/36.5=12mol/L,故答案为:12mol/L;
(3)由稀释定律可知,稀释前后溶质的物质的量不变,则250mL稀释溶液中n(H+)=0.01L×12mol/L=0.12 mol,则n(Zn)=1/2×0.12mol=0.06 mol,m(Zn)= 0.06 mol×65g/mol=3.9g,故答案为:3.9;
(4)250mL稀释溶液中n(H+)=0.01L×12mol/L=0.12 mol,与锌反应生成H2的物质的量为1/2×0.12mol=0.06 mol,由2molH2可以和1molO2完全反应可知,与0.06 mol H2反应的O2的物质的量为1/2×0.06mol=0.03mol,则标准状况下V(O2)0.03mol×22.4L/mol×ml/L=672ml,故答案为:672;
(5)反应后的溶液中n(Cl—)= n(H+),由生成氯化银的反应中消耗Cl—的物质的量等于消耗Ag+物质的量可得:0.6mol/L×V×10—3L=0.12mol,可解得V=200ml,故故答案为:200。


科目:高中化学 来源: 题型:
【题目】下列条件一定能使反应速率加快的是( )
①增加反应物物质的量 ②升高温度 ③缩小反应容器的体积 ④加入生成物 ⑤加入MnO2
A.①②③B.③C.②D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂为了节能减排,将烟道气中SO2和含Ca(OH)2、NaOH的废碱液作用,经过一系列化学变化,最终得到石膏和过二硫酸钠(Na2S2O8)。设计简要流程如图:
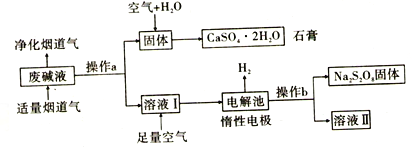
(1)操作a的名称是____________________。废碱液经操作a得到的固体为___________(填化学式)。
(2)向溶液I中通入足量的空气发生反应的化学方程式为_____________________________。
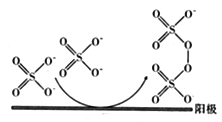
(3)已知用惰性电极电解SO42-可生成S2O82-,其过程如下图所示,S2O82-中S的化合价为__________,阳极生成Na2S2O8的电极反应式为____________________________;在整个流程中可以循环利用的物质是H2O和_________________ (填化学式)。
(4)若制取1mol Na2S2O8且阳极有11.2L的氧气产生(标准状况)。则电解生成的H2在标准状况下的体积为______________L。
(5)烟道气中的SO2可用石灰水吸收,生成亚硫酸钙浊液。常温下,测得某纯CaSO3与水形成的浊液pH为9,已知Ka1 (H2SO3)=1.8×10-2,Ka2 (H2SO3)=6.0×10-9,忽略SO32-的第二步水解,则Ksp(CaSO3)=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】80年代,科学研制得一种新分子,它具有空心的类似足球状的结构,分子式为C60 . 下列说法正确的是( )
A.C60是一种新型的化合物
B.C60含有离子键
C.C60和金刚石互为同位素
D.C60中的化学键只有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法中,不利于实现让海南“天更蓝,山更绿,水更清”目标的是( )
A.污水未经处理直接排入大海B.推广使用清洁能源
C.植树进林,提高森林覆盖率D.推广使用无磷洗涤剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质①NaHSO4 ②HCl ③Cu ④CO2 ⑤Ba(OH)2 ⑥ NaOH ⑦ NaHCO3 ⑧CH3COOH
(1)属于强电解质的是__________(填序号);水溶液能导电的是_______________(填序号)。
(2)写出下列物质在水溶液中的电离方程式
①:__________________________________________
⑦:__________________________________________
⑧:__________________________________________
(3)写出下列物质相互反应的离子方程式
少量的①与⑤:_______________________________________________。
⑥与⑧:_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在反应 KMnO4+ HCl= MnCl2+ KCl+ Cl2↑+ H2O中,MnCl2为易溶于水的强电解质,回答下列问题:
①氧化剂是___________,还原剂是__________;
②配平上述方程式并用双线桥法标明电子转移的方向和数目:______________;
③写出上述反应的离子方程式:_________________________________________;
④若生成71gCl2,被氧化的HCl是_________________g。
(2)单质铁与稀HNO3可发生多种反应,当8/3n(Fe)<n(HNO3)≤4n(Fe)时,反应方程式可用下列通式表示:aFe+bHNO3(稀)=cNO十dFe(NO3)2+eFe(NO3)3十fH2O。
①假设a=16,且b、c、d、e、f均取正整数时,共有_______组系数配比。
②若a、b、c、d、e、f符合上述系数的配比关系,则b与C的关系为:b=____c。
查看答案和解析>>
科目:高中化学 来源: 题型:
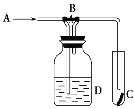
【题目】下图是一种检验某气体化学性质的实验装置,图中B为开关,如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化,当关闭B时,C处红色布条颜色褪去。则D瓶中盛有的溶液是
A. 浓H2SO4溶液 B. 浓NaOH溶液
C. 饱和NaCl溶液 D. 浓NaBr溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化阿托醛  是一种重要的化工原料,其合成路线如下:
是一种重要的化工原料,其合成路线如下:

请根据上述合成路线,回答下列问题:
(1)氢化阿托醛所含官能团的名称为_____________;一定条件下,1 mol氢化阿托醛最多可跟______mol氢气加成。
(2)②的反应类型是__________________。写出它的化学方程式:_____________。
(3)④中所用试剂X为____________。
(4)写出反应⑤的化学方程式:_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com