
 某学习小组用如图装置测定铝美合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图装置测定铝美合金中铝的质量分数和铝的相对原子质量.| 33600(a-c) |
| b |
| 33600(a-c) |
| b |
| (a-c) |
| a |


科目:高中化学 来源: 题型:
| A、他们都用HCl表示两者没有区别 |
| B、氯化氢和盐酸在潮湿的空气中都形成酸雾 |
| C、稀氯化氢和盐酸都能导电 |
| D、氯化氢是无色气体盐酸是无色溶液它们都有刺激性气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:
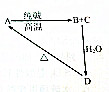 几种含硅物质的相互转化关系如图所示,其中物质A是一种高熔点化合物,不溶于稀硫酸、硝酸,却溶于氢氟酸;C是一种气体;D是白色胶状沉淀.
几种含硅物质的相互转化关系如图所示,其中物质A是一种高熔点化合物,不溶于稀硫酸、硝酸,却溶于氢氟酸;C是一种气体;D是白色胶状沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:R>Q |
| B、R和Q可形成离子化合物 |
| C、R和Q可形成非极性分子RQ2 |
| D、R和Q可形成共价化合物RQ3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
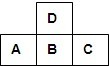 如图为周期表中短周期的一部分,若A原子最外层电子数比次外层电子数少3,则下列说法中不正确的是( )
如图为周期表中短周期的一部分,若A原子最外层电子数比次外层电子数少3,则下列说法中不正确的是( )| A、D的单质可跟B的氢化物的水溶液反应 |
| B、A、C可形成化合物AC5,分子中各原子均满足最外层8电子结构 |
| C、原子半径A>B>C |
| D、C的最高价氧化物对应水化物比B的最高价氧化物对应水化物的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清石灰水、浓H2SO4 |
| B、KMnO4酸性溶液、浓H2SO4 |
| C、溴水、浓H2SO4 |
| D、浓H2SO4、KMnO4酸性溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
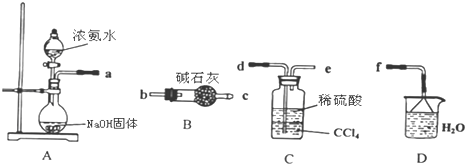
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com