
分析 (1)合金中只有Al能和NaOH溶液反应生成氢气,根据转移电子守恒计算铝物质的量,根据m=nM计算铝质量;
(2)Mg、Al都和稀盐酸反应生成氢气,相同质量的铝和稀盐酸、氢氧化钠溶液生成氢气相同,所以另一份合金中镁与稀盐酸反应生成氢气体积11.2-6.72)L4.48L,根据转移电子守恒计算镁物质的量,从而确定镁铝物质的量之比.
解答 解:(1)合金中只有Al能和NaOH溶液反应生成氢气,n(H2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,根据转移电子守恒得:n(Al)=$\frac{0.3mol×2}{3}$=0.2mol,
则每份合金中铝的质量为:m(Al)=0.2mol×27g/mol=5.4g,
答:每份合金中铝的质量是5.4g;
(2)Mg、Al都和稀盐酸反应生成氢气,相同质量的铝和稀盐酸、氢氧化钠溶液生成氢气相同,所以另一份合金中镁与稀盐酸反应生成氢气体积=(11.2-6.72)L4.48L,n(H2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,根据转移电子守恒计算n(Mg)=$\frac{0.2mol×2}{2}$=0.2mol,
则合金中n(Mg)=0.1mol×2=0.2mol,n(Al)=0.2mol×2=0.4mol,
所以合金中Al、Mg的物质的量之比=0.4mol:0.4mol=1:1,
答:合金中铝、镁的物质的量之比为1:1.
点评 本题考查混合物的有关计算,为高频考点,题目难度中等,灵活运用转移电子守恒是解本题关键,试题侧重考查学生的分析能力及化学计算能力.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:解答题
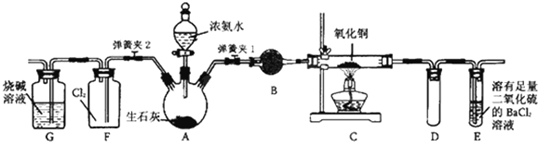
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 基态Mg原子的核外电子排布图: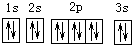 | |
| B. | 过氧化氢的电子式: | |
| C. | As原子的简化电子排布式:[Ar]4s24p3 | |
| D. | 羟基的电子式: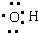 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入KHSO4溶液,平衡逆向移动,Kw减小 | |
| B. | 将水加热,Kw增大,pH减小 | |
| C. | 向水中加入少量固体CH3COONa平衡逆向移动,c(H+)降低 | |
| D. | 向水中加入AlCl3溶液,平衡向右移动,KW增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质硅是良好的半导体材料 | |
| B. | 硅酸比碳酸酸性弱,故二氧化硅不能与碳酸钠反应 | |
| C. | 氢氟酸可以用来雕刻玻璃 | |
| D. | 玻璃、水泥、陶瓷都属于硅酸盐产品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ),其原理如图所示,下列说法正确的是( )
),其原理如图所示,下列说法正确的是( )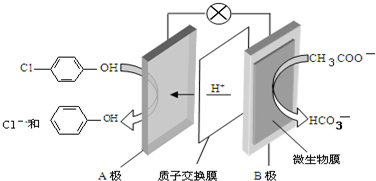
| A. | 当外电路中有0.2mole-转移时,A极区增加的H+的个数为0.1NA | |
| B. | A极的电极反应式为 +e-=Cl-+ +e-=Cl-+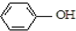 | |
| C. | 电流方向从B极沿导线经小灯泡流向A极 | |
| D. | B为电池的正极,发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 笔杆 | B. | 笔套 | C. | 笔头 | D. | 笔管 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 FeCl3(aq)与KSCN(aq)混合时平衡:Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq);已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T三关系如图所示,则下列说法正确的是( )
FeCl3(aq)与KSCN(aq)混合时平衡:Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq);已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T三关系如图所示,则下列说法正确的是( )| A. | FeCl3(aq)与KSCN(aq)反应是放热反应 | |
| B. | 温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1<K2 | |
| C. | 反应处于D点时,一定有V正>V逆 | |
| D. | A点与B点相比,A点的c(Fe3+)大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com