
【题目】水是极弱的电解质,改变温度或加入某些电解质会影响水的电离。请回答下列问题:
(1)纯水在 100℃时,pH=6,该温度下 0.1molL﹣1 的 NaOH 溶液中,溶液的 pH=_____。
(2)25℃时,向水中加入少量碳酸钠固体,得到 pH 为 11 的溶液,其水解的离子方程式为_____, 由水电离出的 c(OH﹣)=_____molL﹣1。
(3)体积均为 100mL、pH 均为 2 的盐酸与一元酸 HX,加水稀释过程中 pH 与溶液体积的关系如图所示,则 HX 是_____(填“强酸”或“弱酸”),理由是_____。

(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。
化学式 | 电离常数(25℃) |
HCN | K=4.9×10﹣10 |
CH3COOH | K=1.8×10﹣5 |
H2CO3 | K1=4.3×10﹣7、K2=5.6×10﹣11 |
①25℃时,等浓度的 NaCN 溶液、Na2CO3 溶液和 CH3COONa 溶液,pH 由大到小的顺序为________(填化学式)。
②25℃时,在 0.5mol/L 的醋酸溶液中由醋酸电离出的 c(H+)约是由水电离出的 c(H+)的_________倍。
【答案】(1)11(2分)(2)CO32-+H2O![]() HCO3-+OH-(2分) 10-3(2分)
HCO3-+OH-(2分) 10-3(2分)
(3)弱酸(1分);稀释相同倍数,一元酸HX的pH变化量比HCl的小,说明HX存在电离平衡,故HX为弱酸。(2分) (4)①Na2CO3>NaCN>CH3COONa(2分) ②9×108(2分)
【解析】
试题(1)纯水在100 ℃时,pH=6,这说明该温度下水的离子积常数是10-12,因此该温度下0.1 mol·L-1的NaOH溶液中,氢离子浓度是10-11mol/L,则溶液的pH=11。
(2)25 ℃时,向水中加入少量碳酸钠固体,碳酸根水解,得到pH为11的溶液,则其水解的离子方程式为CO32-+H2O![]() HCO3-+OH-,其中由水电离出的c(OH-)等于溶液中氢氧根离子的浓度,即由水电离出的c(OH-)=10-3mol·L-1。
HCO3-+OH-,其中由水电离出的c(OH-)等于溶液中氢氧根离子的浓度,即由水电离出的c(OH-)=10-3mol·L-1。
(3)根据图像可知,稀释相同倍数时,一元酸HX的pH变化量比HCl的小,这说明HX存在电离平衡,因此HX为弱酸。
(4)①电离常数越大酸性越强,酸性越强相应的钠盐越容易水解,溶液的碱性越强。根据表中数据可知酸性强弱顺序为CH3COOH>H2CO3>HCN>HCO3-,所以25 ℃时,等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,溶液的pH由大到小的顺序为Na2CO3>NaCN>CH3COONa。
②根据电离常数可知25 ℃时,在0.5 mol/L 的醋酸溶液中氢离子浓度是![]() mol/L,则溶液中氢氧根离子的浓度是
mol/L,则溶液中氢氧根离子的浓度是![]() ×10-11mol/L,因此醋酸溶液中由水电离出的氢离子浓度也是
×10-11mol/L,因此醋酸溶液中由水电离出的氢离子浓度也是![]() ×10-11mol/L,所以由醋酸电离出的c(H+)约是由水电离出的c(H+)的
×10-11mol/L,所以由醋酸电离出的c(H+)约是由水电离出的c(H+)的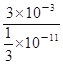 9×108倍。
9×108倍。


科目:高中化学 来源: 题型:
【题目】有关分子结构如图所示,下列叙述中,正确的是 ( )
![]()
A. 除苯环外的其余碳原子有可能都在一条直线上
B. 所有的原子都在同一平面上
C. 12个碳原子不可能都在同一平面上
D. 12个碳原子有可能都在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向10mL0.1mol·Lˉ1NaOH溶液中加入0.1mol·Lˉ1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是

A.a点所示溶液中c(Na+)>c(Aˉ)>c(H+)>c(HA)
B.pH=7时,加入HA的体积<10mL
C.pH=7时,c(Na+)=c(Aˉ)+c(HA)
D.b点所示溶液中c(Aˉ)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学用 NaHCO3和KHCO3组成的某均匀混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)
实验序号 | I | II | III |
盐酸体积(mL) | 100.0 | 100.0 | 100.0 |
样品质量/g | 9.2 | 15.7 | 27.6 |
CO2体积/L (标准状况) | 2.24 | 3.36 | 3.36 |
(1)该盐酸的物质的量浓度为______mol·Lˉ1
(2)使盐酸恰好完全反应,所需要的样品质量为______g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆 AB 两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠 杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓 CuSO4 溶液,一段时间后,下列 有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)

A. 杠杆为导体和绝缘体时,均为 A 端高 B 端低
B. 杠杆为导体和绝缘体时,均为 A 端低 B 端高
C. 当杠杆为绝缘体时,A 端低 B 端高;为导体时,A 端高 B 端低
D. 当杠杆为绝缘体时,A 端高 B 端低;为导体时,A 端低 B 端高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 Q、R、T、W 在元素周期表中的位置如图所示,其中 T 所处的周期数与主族序数相等。
![]()
(1)W 在周期表中的位置是_______,Q、R、T 三种元素原子半径由大到小的顺序为_______________________(用元素符号表示),Q 的最高价氧化物的化学式为________________,
(2)元素的原子得电子 能力:Q________________W(填“强于”或“弱于”)。
(3)原子序数比 R 多 1 的元素有一种氢化物能分解为它的另一种氢化物,该反应的化学方程式为______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是
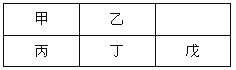
A. 原子半径:丙<丁<戊B. 金属性:甲>丙
C. 氢氧化物碱性:丙>丁>戊D. 最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主要用于高分子胶囊和印刷油墨的粘合剂的甲基两烯酸缩水油酯GMA(即:![]() )的合成路线如下(部分反应所需试剂和条件已略去):
)的合成路线如下(部分反应所需试剂和条件已略去):

已知:
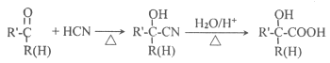
请按要求回答下列问题:
(1)GMA的分子式______________________;B中的官能团名称:______________________;甘油的系统命名:______________________。
(2)验证D中所含官能团各类的实验设计中,所需试剂有______________________。
(3)写出下列反应的化学方程式:反应⑤:____________________。反应⑧:______________________。
(4)M是H的同分异构体。M有多种同分异构体,写出满足下述所有条件的M的所有可能的结构:____________________________。
①能发生银镜反应 ②能使溴的四氯化碳溶液褪色 ③能在一定条件下水解
(5)已知: { 2 }![]()
![]()
![]() 。参照上述合成路线并结合此信息,以丙烯为原料,完善下列合成有机物C的路线流程图:丙烯
。参照上述合成路线并结合此信息,以丙烯为原料,完善下列合成有机物C的路线流程图:丙烯![]() Br
Br![]() ________________________。
________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A. 可用溴的四氯化碳溶液区别![]() 和
和![]()
B. 甲苯分子中所有原子在同一平面上
C. 苯、乙酸、乙醇均能发生取代反应
D. 分子式为C3H6Cl2的同分异构体共有4种(不考虑立体异构)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com