
| 起始温度/℃ | 终止温度/℃ | 温度差/℃ | |||
| H2SO4溶液 | NaOH溶液 | 平均值 | |||
| 1 | 25.0 | 24.5 | 24.75 | 29.3 | 4.55 |
| 2 | 24.5 | 24.2 | 24.35 | 28.3 | 3.95 |
| 3 | 25.0 | 24.5 | 24.75 | 28.7 | 3.95 |
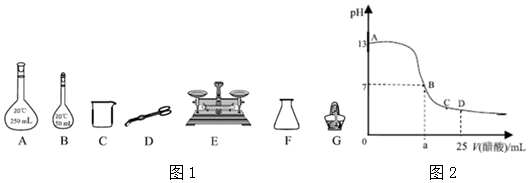
分析 (1)根据公式m=nM=cVM来计算氢氧化钠的质量,但是没有245mL的容量瓶;
(2)依据配制一定物质的量浓度溶液一般步骤选择需要仪器;
(3)先判断温度差的有效性,然后求出温度差平均值;
先根据Q=m•c•△T计算反应放出的热量,然后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热;
(4)A.实验装置保温、隔热效果必须好;
B.量取NaOH溶液的体积时视线要和凹液面相平;
C.允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中;
D.用温度计测定NaOH溶液起始温度后,要将温度计回零直再测定H2SO4溶液的温度;
(5)二者反应生成醋酸钠和水;
(6)依据未加入醋酸时氢氧化钠溶液pH值计算氢氧化钠物质的量浓度;
(7)D点醋酸应稍过量,且c(OH-)=c(H+),注意根据电荷守恒思想来比较离子浓度大小.
解答 解:(1)没有245mL的容量瓶,所以用250mL的容量瓶,需要称量NaOH固体m=nM=cVM=0.5mol/L×0.25L×40g/mol=5.0g,
故答案为:5.0;
(2)配制一定物质的量浓度溶液一般步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶等,用到的仪器有:托盘天平、药匙、烧杯、筒量、玻璃棒、容量瓶、胶头滴管,配制245mL溶液,应选择250mL容量瓶;
故选:ACE;
(3)3次温度差分别为:4.55℃,3.95℃,3.95℃,第一组数据误差较大舍弃,2组数据都有效,温度差平均值=3.95℃,
50mL0.5mol/L的NaOH溶液与30mL0.5mol/L的H2SO4溶液反应,硫酸过量,依据氢氧化钠的量计算生成水的物质的量为:0.05L×0.5mol/L=0.025mol;溶液的质量为80g,
则生成0.025mol水放出的热量为Q=m•c•△T=80g×4.18J/(g•℃)×3.95℃=1320.88J,即1.321KJ,
所以实验测得的中和热△H=-$\frac{1.321KJ}{0.025mol}$=-52.8KJ/mol;
故答案为:-52.8KJ/mol;
(4)A.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故A选;
B.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故B不选;
C.尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,不允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中,否则部分热量散失,中和热数值偏小,故C选;
D.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故D选;
故选:ACD;
(5)NaOH溶液与CH3COOH溶液反应生成醋酸钠和水,离子方程式:CH3COOH+OH-=CH3COO-+H2O;
故答案为:CH3COOH+OH-=CH3COO-+H2O;
(6)依据图象可知,未加入醋酸时,氢氧化钠溶液pH值为13,则氢离子浓度为10-13mol/L,氢氧根离子浓度为$\frac{10{\;}^{-14}}{10{\;}^{-13}}$=0.1mol/L;
故答案为:0.1mol/L;
(7)在D点时,醋酸剩余,溶液显酸性,故有c(OH-)<c(H+),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(Na+)<c(CH3COO-),所以溶液中离子浓度大小关系为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
点评 本题考查热化学方程式以及反应热的计算,酸碱混合后的定性判断及溶液中离子浓度大小比较,题目难度大,注意理解中和热的概念、把握热化学方程式的书写方法,以及测定反应热的误差等问题,注意电荷守恒、物料守恒等比较溶液中离子浓度大小,试题培养了学生灵活应用的所学知识的能力.


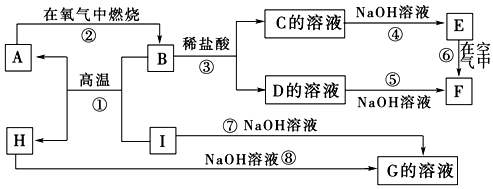
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室某浓硫酸的试剂瓶上的标签如右图所示,根据标签上的有关数据回答下列问题:
实验室某浓硫酸的试剂瓶上的标签如右图所示,根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
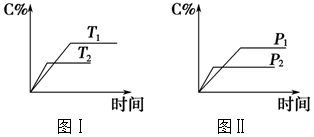
| A. | 化学方程式中m+n<e+f | |
| B. | 达平衡后,若升温,平衡左移 | |
| C. | 达平衡后,加入催化剂则C%增大 | |
| D. | 达平衡后,增加A的量有利于平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测定序号 | NaHCO3溶液的体积/mL | 盐酸标准液滴定管中的读数/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 1.50 | 21.52 |
| 2 | 20.00 | 1.80 | 25.62 |
| 3 | 20.00 | 0.20 | 20.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
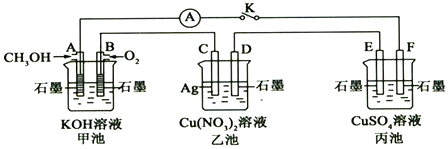
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
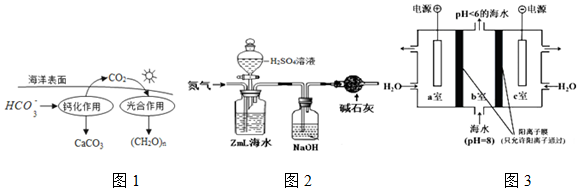
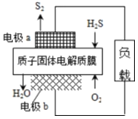 科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫.质子膜H2S燃料电池的结构示意图如图所示.下列说法不正确的是( )
科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫.质子膜H2S燃料电池的结构示意图如图所示.下列说法不正确的是( )| A. | 电极a为电池的负极 | |
| B. | 电极b上发生的电极反应为:O2+4H++4e-═2H2O | |
| C. | 电路中每流过4 mol电子,在正极消耗44.8LH2S | |
| D. | 每17 g H2S参与反应,有1 mol H+经质子膜进入正极区 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com