
【题目】X、Y、Z、W、T是原子序数依次増大的五种短周期元素,且X、Y、Z、W的原子序数之和为32。其中X是元素周期表中原子半径最小的元素,Y、Z左右相邻,Z、W位于同一主族。T的单质常用于自来水的杀菌消毒。
请回答下列问题:
(1)W元素在周期表中的位置为:____________________
(2)由 X、Y、Z、W四种元素中的三种组成一种强酸,该强酸的稀溶液能与金属铜反应,该反应的离子方程式为____________________。
(3)Y元素的气态氢化物与其最高价氧化物的水化物可以相互反应,写出其离子方程式:______________
(4)Y和T两元素的非金属性强弱为Y________T (填“>”“<”或者“=”)。可以验证该结论的方法是___________________
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素所形成含氧酸的酸性
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素与氢气化合的难易程度
E.比较这两种元素气态氢化物的还原性
(5)某化学兴趣小组欲通过实验探究元素N、C、Si 非金属性强弱。实验装置如下:
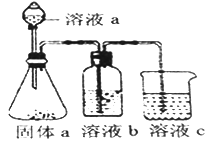
①溶液a和溶液b分别为__________溶液、________溶液(填溶质化学式)
②经验证,N、C、Si的非金属性由强到弱为:__________
【答案】 第三周期第VIA族 3Cu + 8H+ +2NO3- = 3Cu2+ +2NO↑ +4H2O NH3 + H+=NH4+ < CDE HNO3 NaHCO3 N>C>Si
【解析】根据元素的原子序数相对大小、数量关系,然后结合元素在周期表中的相对位置以及有关元素的性质判断出元素种类,最后结合对应单质、化合物的性质以及元素周期律的递变规律逐一分析解答。
X是元素周期表中原子半径最小的元素,应为H元素,Y、Z左右相邻,Z、W位于同一主族,且原子序数依次增大,可设Z的原子序数为a,则Y的原子序数为a-1,W的原子序数为a+8,故有1+a+a-1+a+8=32,a=8,因此Y、Z、W分别为N、O、S元素,T的单质常用于自来水的杀菌消毒,提纯T是Cl。
(1)S元素的原子序数是16,在周期表中的位置为第三周期第VIA族;(2)由 X、Y、Z、W四种元素中的三种组成一种强酸,该强酸的稀溶液能与金属铜反应,该强酸是稀硝酸,反应的离子方程式为3Cu + 8H+ +2NO3- =3Cu2+ +2NO↑ +4H2O;(3)N元素的气态氢化物与其最高价氧化物的水化物可以相互反应生成硝酸铵,其离子方程式为NH3 + H+=NH4+;(4)氯元素的非金属性强于氮元素,A.非金属性强弱与元素的气态氢化物的沸点无关,A错误;B.非金属性越强,最高价含氧酸的酸性越强,因此比较这两种元素所形成含氧酸的酸性不能比较非金属性强弱,B错误;C.非金属性越强,氢化物越稳定,因此比较这两种元素的气态氢化物的稳定性可以比较非金属性强弱,C正确;D.非金属性越强,越容易与氢元素化合,因此比较这两种元素与氢气化合的难易程度可以比较非金属性强弱,D正确;E.非金属性越强,相应阴离子的还原性越弱,因此比较这两种元素气态氢化物的还原性可以比较非金属性强弱,E正确,答案选CDE;(5)①要通过实验探究元素N、C、Si 非金属性强弱,可以依据较强酸制备较弱酸完成。即利用硝酸与碳酸盐反应生成CO2,CO2通入硅酸钠溶液中,由于硝酸易挥发,生成的CO2中混有硝酸气体,所以溶液a和溶液b分别为HNO3溶液、饱和NaHCO3溶液;②经验证,N、C、Si的非金属性由强到弱为N>C>Si。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在体积均为1.0L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 CO2和0.2molCO2,在不同温度下反应CO2(g)+c(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是

A.反应CO2(g)+c(s)![]() 2CO(g) △S>0、△H<0
2CO(g) △S>0、△H<0
B.体系的总压强P总:P总(状态Ⅱ)>2P总(状态Ⅰ)
C.体系中c(CO):c(CO,状态Ⅱ)>2c(CO,状态Ⅲ)
D.逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制250ml 1.6mol·L-1的NaOH溶液,请回答下列问题:
(1)称取NaOH固体______g。
(2)在配制该溶液的过程中,需经过称量、溶解、转移溶液、定容等操作,下列图示对应的操作规范是____。根据图示,除称量外还缺少的操作步骤依次是________、__________。

(3)在配制过程中,如果其他操作都正确,下列操作会引起NaOH溶液浓度偏低的是_______。
A. 称量好的固体放置一段时间后进行溶解操作
B. 溶液未冷却至室温即转移到容量瓶中
C. 容量瓶水洗后未干燥
D. 转移溶液时不慎有少量溶液滴出瓶外
E. 定容时不小心有蒸馏水滴出瓶外
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸的酸式盐NaHY的水溶液中,HY-的电离程度小于HY-的水解程度,有关叙述正确的是
A.H2Y在电离时:H2Y+H2O![]() HY-+H3O+
HY-+H3O+
B.在该盐的溶液中,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
C.在该盐的溶液中,离子浓度为:c(Na+)>c(HY-)>c(Y2-)>c(OH-)>c(H+)
D.HY-水解方程式为:HY-+H2O![]() Y2-+H3O+
Y2-+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把含有氧化铁的铁片投入到足量的稀盐酸中,直到铁片完全溶解,经分析该溶液中无Fe3+ , 且生成的Fe2+与反应生成的H2的物质的量之比为3:1,则原混合物中Fe2O3与Fe的物质的量之比为( )
A.1:1
B.2:5
C.4:1
D.3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2H4是一种高效清洁的火箭燃料。已知0.5molN2H4(g)完全燃烧生成氨气和气态水时,放出267kJ热量.则下列热化学方程中正确的是
A.![]() N2H4(g)+
N2H4(g)+![]() O2(g)=
O2(g)=![]() N2(g)+H2O(g) △H=+267kJ/mol
N2(g)+H2O(g) △H=+267kJ/mol
B.N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534kJ/mol
C.N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=+534kJ/mol
D.N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中可逆反应2NO2(g)![]() 2NO(g)+O2(g),达到平衡状态的标志是
2NO(g)+O2(g),达到平衡状态的标志是
①单位时间内生成n molO2的同时生成2n mol NO2
②单位时间内生成n molO2的同时生成2n mol NO
③混合气体的颜色不再改变的状态
④用NO2、NO、O2表示的反应速率的比为2:2:1的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
⑧2V正(NO2)=2V逆(O2)
A.①③⑥⑦ B.②⑤⑥⑦ C.①③④⑤⑧ D.①②③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,既是离子反应,又是氧化还原反应的是( )
A.2NaOH+H2SO4===Na2SO4+2H2O
B.Fe+H2SO4===FeSO4+H2↑
C.BaCl2+H2SO4===BaSO4↓+2HCl
D.H2+CuO===Cu+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com