
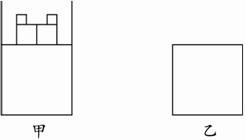
(1)甲容器达平衡状态时SO2的转化率_____________________________。
(2)甲容器达到平衡所需的时间________________乙容器达到平衡所需时间(填“大于”“小于”或“等于”);反应过程中放出的能量,甲_______________乙(填“大于”“小于”或“等于”),其原因是____________________________________________________________。
(3)甲、乙两容器达到平衡状态后,若要使甲、乙两容器中SO2浓度相等,可以采取的措施是:________________________________________。
A.保持温度不变,适当扩大甲容器的体积?
B.保持容器体积不变,使容器乙升温?
C.保持容器的体积和温度不变,向乙容器加入适量的SO3??
D.保持容器的体积和温度不变,向甲容器加入适量的SO3??
(4)若起始时,甲容器加入a mol SO2、b mol O2和c mol SO3,保持温度不变,达到平衡时,混合气体中各气体的体积分数与题干中甲容器相同。则a、b、c应满足的条件是:________________________________________________。
科目:高中化学 来源: 题型:
(18分)A、B、C、D、E五种短周期元素,原子序数依次增大。A元素的单质是自然界最轻的气体,E单质须保存在煤油中。A与B、C分别构成电子数相等的化合物M、N,且M是一种能产生温室效应的最简单的有机气体物质;D元素最外层电子数是次外层电子数的3倍;回答下列问题:
(1)N的电子式为 ;M分子中含有 (填“极性”或“非极性”)键
(2)D与E以1:1形成的化合物与水反应的化学反应方程式
(3)A、B、C、D可形成阳离子和阴离子个数比是1∶1的离子化合物X;A、D、E可形成化合物Y;X与Y以物质的量之比1∶2加热反应,写出反应的化学方程式
反应后水溶液显 (填“酸”“碱”或“中”)性,原因是 (用离子方程式表示)
(4)由N与D的单质、KOH溶液构成原电池,负极会产生C的单质。则其负极反应为 ;一段时间后,溶液pH (填“增大”“减小”或“不变”)。
![]() (5)在一定温度下,将4 mol C单质和12 mol A单质通入到体积为2L的密闭容器中,发生反应,2min达到平衡状态时,A单质的转化率是50%,则用A单质表示该反应的平均速率为 ;该温度下的平衡常数为K= 。
(5)在一定温度下,将4 mol C单质和12 mol A单质通入到体积为2L的密闭容器中,发生反应,2min达到平衡状态时,A单质的转化率是50%,则用A单质表示该反应的平均速率为 ;该温度下的平衡常数为K= 。
从化学平衡移动的角度分析,提高A单质的转化率可以采取的措施是 (选填序号字母)。
a、及时分离出生成物 b、平衡后再加入6molA物质 c、增大压强 d、使用催化剂 e、平衡后再加入2molC物质
查看答案和解析>>
科目:高中化学 来源:2011届北京延庆县高三第一次模拟考试(理综)化学部分 题型:填空题
(18分)A、B、C、D、E五种短周期元素,原子序数依次增大。A元素的单质是自然界最轻的气体,E单质须保存在煤油中。A与B、C分别构成电子数相等的化合物M、N,且M是一种能产生温室效应的最简单的有机气体物质;D元素最外层电子数是次外层电子数的3倍;回答下列问题:
(1)N的电子式为 ;M分子中含有 (填“极性”或“非极性”)键
(2)D与E以1:1形成的化合物与水反应的化学反应方程式
(3)A、B、C、D可形成阳离子和阴离子个数比是1∶1的离子化合物X;A、D、E可形成化合物Y;X与Y以物质的量之比1∶2加热反应,写出反应的化学方程式
反应后水溶液显 (填“酸”“碱”或“中”)性,原因是 (用离子方程式表示)
(4)由N与D的单质、KOH溶液构成原电池,负极会产生C的单质。则其负极反应为 ;一段时间后,溶液pH (填“增大”“减小”或“不变”)。 (5)在一定温度下,将4 mol C单质和12 mol A单质通入到体积为2L的密闭容器中,发生反应,2 min达到平衡状态时,A单质的转化率是50%,则用A单质表示该反应的平均速率为 ;该温度下的平衡常数为K= 。
(5)在一定温度下,将4 mol C单质和12 mol A单质通入到体积为2L的密闭容器中,发生反应,2 min达到平衡状态时,A单质的转化率是50%,则用A单质表示该反应的平均速率为 ;该温度下的平衡常数为K= 。
从化学平衡移动的角度分析,提高A单质的转化率可以采取的措施是 (选填序号字母)。
a、及时分离出生成物 b、平衡后再加入6molA物质 c、增大压强 d、使用催化剂 e、平衡后再加入2molC物质
查看答案和解析>>
科目:高中化学 来源:2010-2011学年北京延庆县高三第一次模拟考试(理综)化学部分 题型:填空题
(18分)A、B、C、D、E五种短周期元素,原子序数依次增大。A元素的单质是自然界最轻的气体,E单质须保存在煤油中。A与B、C分别构成电子数相等的化合物M、N,且M是一种能产生温室效应的最简单的有机气体物质;D元素最外层电子数是次外层电子数的3倍;回答下列问题:
(1)N的电子式为 ;M分子中含有 (填“极性”或“非极性”)键
(2)D与E以1:1形成的化合物与水反应的化学反应方程式
(3)A、B、C、D可形成阳离子和阴离子个数比是1∶1的离子化合物X;A、D、E可形成化合物Y;X与Y以物质的量之比1∶2加热反应,写出反应的化学方程式
反应后水溶液显 (填“酸”“碱”或“中”)性,原因是 (用离子方程式表示)
(4)由N与D的单质、KOH溶液构成原电池,负极会产生C的单质。则其负极反应为 ;一段时间后,溶液pH (填“增大”“减小”或“不变”)。
 (5)在一定温度下,将4 mol C单质和12 mol A单质通入到体积为2L的密闭容器中,发生反应,2
min达到平衡状态时,A单质的转化率是50%,则用A单质表示该反应的平均速率为
;该温度下的平衡常数为K=
。
(5)在一定温度下,将4 mol C单质和12 mol A单质通入到体积为2L的密闭容器中,发生反应,2
min达到平衡状态时,A单质的转化率是50%,则用A单质表示该反应的平均速率为
;该温度下的平衡常数为K=
。
从化学平衡移动的角度分析,提高A单质的转化率可以采取的措施是 (选填序号字母)。
a、及时分离出生成物 b、平衡后再加入6molA物质 c、增大压强 d、使用催化剂 e、平衡后再加入2molC物质
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E五种短周期元素,原子序数依次增大。A元素的单质是自然界最轻的气体,E单质须保存在煤油中。A与B、C分别构成电子数相等的化合物M、N,且M是一种能产生温室效应的最简单的有机气体物质;D元素最外层电子数是次外层电子数的3倍;回答下列问题:
(1)N的电子式为 ;M分子中含有 (填“极性”或“非极性”)键
(2)D与E以1:1形成的化合物与水反应的化学反应方程式
(3)A、B、C、D可形成阳离子和阴离子个数比是1∶1的离子化合物X;A、D、E可形成化合物Y;X与Y以物质的量之比1∶2加热反应,写出反应的化学方程式
反应后水溶液显 (填“酸”“碱”或“中”)性,原因是 (用离子方程式表示)
(4)由N与D的单质、KOH溶液构成原电池,负极会产生C的单质。则其负极反应为 ;一段时间后,溶液pH (填“增大”“减小”或“不变”)。
![]() (5)在一定温度下,将4 mol C单质和12 mol A单质通入到体积为2L的密闭容器中,发生反应,2 min达到平衡状态时,A单质的转化率是50%,则用A单质表示该反应的平均速率为 ;该温度下的平衡常数为K= 。
(5)在一定温度下,将4 mol C单质和12 mol A单质通入到体积为2L的密闭容器中,发生反应,2 min达到平衡状态时,A单质的转化率是50%,则用A单质表示该反应的平均速率为 ;该温度下的平衡常数为K= 。
从化学平衡移动的角度分析,提高A单质的转化率可以采取的措施是 (选填序号字母)。
a、及时分离出生成物 b、平衡后再加入6molA物质 c、增大压强 d、使用催化剂 e、平衡后再加入2molC物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com