
甲、乙、丙三种有机物的结构简式如下图所示,下列说法不正确的是
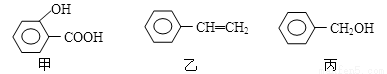
A.甲、乙、丙都能发生加成反应、取代反应
B.丙与C6H5OH都含有-OH,质谱图显示的质荷比最大值相差14,但不属于同系物
C.淀粉、油脂、有机玻璃等都属于高分子化合物
D.乙的化学名称为苯乙烯,能使溴水褪色,但不存在顺反异构体
科目:高中化学 来源:2014-2015学年广东省梅州市高三高三总复习质检理综化学试卷(解析版) 题型:选择题
设nA为阿伏加德罗常数,下列说法正确的是
A.常温下,28g C2H4含nA个碳碳双键
B.1 mol Cu和足量稀硝酸反应生成nA NO分子
C.常温常压下,22.4L CCl4含有n A个CCl4分子
D.1mol/L NaCl溶液含有n A个Na+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省郑州市高三第二次质量预测理综化学试卷(解析版) 题型:填空题
(14分)CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法。
I、甲醇可以补充和部分替代石油燃料,缓解能源紧张。利用CO可以合成甲醇。
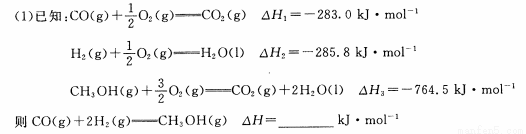
(2)一定条件下,在容积为VL的密闭容器中充入α mol CO与2a mol H2合成甲醇平衡转化率与温度、压强的关系如图所示。
①P1__P2(填“>”、“<”或“=”),理由是
②该甲醇合成反应在A点的平衡常数K= (用a和V表示)
③该反应达到平衡时,反应物转化率的关系是:CO H2(填“>” 、“<” 或“=” )
④下列措施中能够同时满足增大反应速率和提高CO转化率的是 。(填写相应字母)
A、使用高效催化剂
B、降低反应温度
C、增大体系压强
D、不断将CH30H从反应混合物中分离出来
E、增加等物质的量的CO和H2
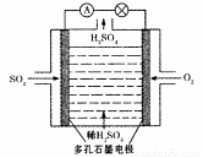
Ⅱ、某学习小组以SO2为原料,采用电化学方法制取硫酸。
(3)原电池法:该小组设计的原电池原理如图所示。写出该电池负极的电极反应式 。
(4)电解法:该小组用Na2SO3溶液充分吸收S02得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如下图所示。
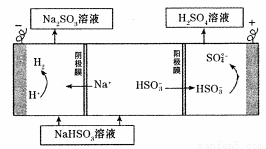
写出开始电解时阳极的电极反应式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市延庆县高三3月模拟理综化学试卷(解析版) 题型:选择题
下列解释事实的方程式不正确的是
A.测0.01mol/L的醋酸的pH为5:CH3COOH CH3COO- + H+
CH3COO- + H+
B.电解饱和食盐水,产生气体:2Cl- + 2H2O Cl2↑ +2OH- + H2↑
Cl2↑ +2OH- + H2↑
C.铁放在氧气中燃烧,产生黑色固体:4Fe +3O2 2Fe2O3
2Fe2O3
D.硫酸钙与碳酸钠溶液,产生白色沉淀:CaSO4(S)+CO32- CaCO3(S)+SO42-
CaCO3(S)+SO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市门头沟区高三3月综合练习理综化学试卷(解析版) 题型:填空题
(16分)合成有机玻璃树脂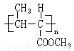 和高聚物H的合成路线如下:
和高聚物H的合成路线如下:

已知:
RCOOR′+ R″OH  RCOOR″ + R′OH (R、R′、R″代表烃基)
RCOOR″ + R′OH (R、R′、R″代表烃基)
CH2=CH—CH=CH2+CH2=CH2 

试回答:
(1)E中官能团的名称是 。
(2)C到D的反应类型是 ,D到E反应的“一定条件”是 。
(3)下列说法正确的是(选填字母) 。
A.乙可使Br2的CCl4溶液褪色
B.G与乙二醇互为同系物
C.D的核磁共振氢谱有4组峰,且峰面积之比为3:1:1:1
D.生成有机玻璃树脂和高聚物H均为加聚反应
(4)B到C的化学方程式是 。
(5)乙的同分异构体中含有酯基的有 种,写出其中能发生银镜反应的一种同分异构体的结构简式 。
(6)生成高聚物H的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市房山区高三一模理综化学试卷(解析版) 题型:填空题
(14分)碳和氮的化合物与人类生产、生活密切相关。
(1)C、CO、CO2在实际生产中有如下应用:
a.2C + SiO2 Si + 2CO b.3CO + Fe2O3
Si + 2CO b.3CO + Fe2O3 2Fe + 3CO2
2Fe + 3CO2
c.C + H2O CO + H2 d.CO2 + CH4
CO + H2 d.CO2 + CH4 CH3COOH
CH3COOH
上述反应中,理论原子利用率最高的是 。
(2)有机物加氢反应中镍是常用的催化剂。但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为搞清该方法对催化剂的影响,查得资料:
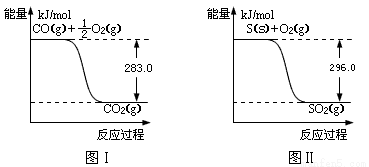
则:① 不用通入O2氧化的方法除去CO的原因是 。
② SO2(g) + 2CO(g) = S(s) + 2CO2(g) △H = 。
(3)汽车尾气中含大量CO和氮氧化物(NO )等有毒气体。
)等有毒气体。
①活性炭处理NO的反应:C(s)+2NO(g) N2(g)+CO2 (g) H=-a kJ·mol-1(a>0)
N2(g)+CO2 (g) H=-a kJ·mol-1(a>0)
若使NO更加有效的转化为无毒尾气排放,以下措施理论上可行的是: 。

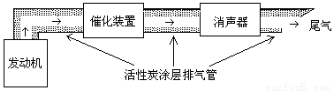
a.增加排气管长度 b.增大尾气排放口
c.添加合适的催化剂 d.升高排气管温度
②在排气管上添加三元催化转化装置,CO能与氮氧化物(NO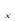 )反应生成无毒尾气,其化学方程式是 。
)反应生成无毒尾气,其化学方程式是 。
(4)利用CO2与H2反应可合成二甲醚(CH3OCH3)。以KOH为电解质溶液,组成二甲醚 空气燃料电池,该电池工作时其负极反应式是 。
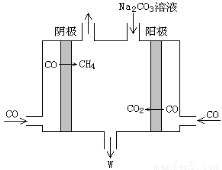
(5)电解CO制备CH4和W,工作原理如图所示,生成物W是 ,其原理用电解总离子方程式解释是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市房山区高三一模理综化学试卷(解析版) 题型:选择题
通常海水的pH=8.1,在稳定海水pH中起作用的离子是
A.Na+ B.HCO3- C.CO32- D.Cl-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省洛阳市高三第二次统一考试理综化学试卷(解析版) 题型:填空题
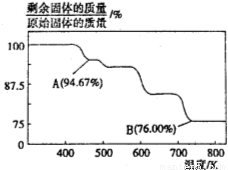
(14分)CrO3主要用于电镀工业,做自行车、仪表等日用五金电镀铬的原料。CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示。
请回答下列问题:
(1)B点时剩余固体的化学式是____________。
(2)加热至A点时反应的化学方程式为______________________________。
(3)CrO3具有两性,写出CrO3溶解予KOH溶液的反应化学方程式____________________。
(4)三氧化铬还用于交警的酒精测试仪,以检查司机是否酒后驾车。若反应后红色的CrO3变为绿色的Cr2(SO4)3,酒精被完全氧化为CO2,则其离子方程式为_______________。
(5)由于CrO3和K2Cr2O7均易溶于水,所以电镀废水的排放是造成铬污染的主要原因。某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如图:
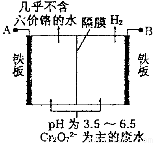
①A为电源___________极,阳极区溶液中发生的氧化还原反应为________________________。
②已知电解后阳极区溶液中c(Fe3+)为2.0×10-13 mol·L-1,则c(Cr3+)为__________mol·L-1。{已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31}
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高一4月月考理科化学试卷(解析版) 题型:选择题
下列表达方式正确的是
A.CCl4的电子式: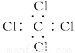
B.MgCl2的电子式: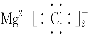
C.S2-的结构示意图: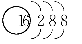
D.中子数为20的氯原子:20Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com