
 +Na2Cr2O7+H2SO4$\stackrel{55℃~60℃}{→}$
+Na2Cr2O7+H2SO4$\stackrel{55℃~60℃}{→}$ +H2O
+H2O| 物质 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水和醚 |
| 环己酮 | 155.6(95)* | 0.9478 | 微溶于水,能溶于醚 |
| 水 | 100.0 | 0.9982 |

 .
. 分析 (1)环己醇氧化为环己酮为放热反应;
(2)蒸馏出产品环已酮;玻管内的水位升高过多,说明压强过大;
(3)环己酮的提纯时应首先加入NaCl固体,使水溶液的密度增大,将水与有机物更容易分离开来,然后向有机层中加入无水MgSO4,出去有机物中少量的水,然后过滤,除去硫酸镁晶体,再进行蒸馏即可;分液需要的主要仪器为分液漏斗,过滤需要由漏斗组成的过滤器;
(4)羟基能发生消去反应.
解答 解:(1)环己醇氧化为环己酮为放热反应,温度过高会引起副反应,故答案为:环己醇氧化为环己酮为放热反应,防止温度过高副反应增多;
(2)蒸馏出产品环已酮;玻管内的水位升高过多,说明压强过大,系统有堵塞现象,应让水蒸汽发生器和大气相通,故答案为:蒸馏出产品环已酮;系统有堵塞现象;打开止水夹K(让水蒸汽发生器和大气相通);
(3)环己酮的提纯时应首先加入NaCl固体,使水溶液的密度增大,水与有机物更容易分离开,然后向有机层中加入无水MgSO4,除去有机物中少量的水,然后过滤,除去硫酸镁晶体,再进行蒸馏即可,则操作为d b e c a;
分液需要的主要仪器为分液漏斗,过滤需要由漏斗组成的过滤器;联系制取肥皂的盐析原理,即增加水层的密度,有利于分层,环己酮的提纯时应首先加入NaCl固体,使水溶液的密度增大,将水与有机物更容易分离开来;乙醚沸点34.6℃,可用水浴加热,
故答案为:d b e c a;漏斗、分液漏斗;增加水层的密度,有利于分层;干燥剂;水浴加热;
(4)羟基能发生消去反应, ,故答案为:
,故答案为: .
.
点评 本题考查学生的读图、识表能力,能够迅速在图、表中提取到有用信息,利用信息解决有关问题.主要考查知识点还有:过滤、分液以及等效氢等知识,学生要善于整合表中数据获取信息,准确把握基础实验知识,尤其是物质的分离和提纯实验操作是高中阶段经常考查的问题,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量之比为2:1 | B. | 质量比为2:1 | ||
| C. | 质量比为 1:2 | D. | 物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,对于二羟基苯甲酸的下列说法,不正确的是( )
,对于二羟基苯甲酸的下列说法,不正确的是( )| A. | 二羟基苯甲酸既具有羧酸的性质,又具有酚的性质 | |
| B. | 1mol二羟基苯甲酸只能与1mol NaOH发生中和反应 | |
| C. | 二羟基苯甲酸溶液中滴加三氯化铁溶液,可以得到紫色溶液 | |
| D. | 二羟基苯甲酸可通过甲苯的氧化、取代、水解等反应制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol CO32- | B. | 0.5mol Na+ | C. | 3.01×1023个Na+ | D. | 3.01×1023个O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn2+、Cu、Fe2+ | B. | Zn2+、Cu2+、Fe、Fe2+ | ||
| C. | Zn2+、Cu2+、Fe2+ | D. | Zn2+、Cu2+、Cu、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
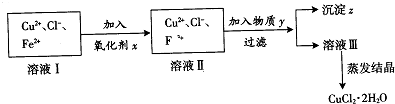
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com