
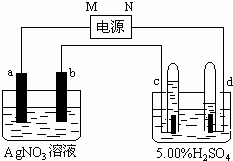
 如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体.请回答下列问题.
如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体.请回答下列问题.分析 根据题意知,电解稀硫酸时,实际上电解的是水,在c、d两极上共收集到336mL并且c少d多,则c收集的为氧气,d收集的为氢气,所以c为阳极,d为阴极,所以M为正极,N为负极,活性电极Ag作阳极,Pt电极作阴极即a作阳极,b为阴极;
(1)根据以上分析确定N的电极;
(2)在铂电极上镀银时,阳极上的电极反应式为Ag-e-=Ag+,阴极上的电极反应式为Ag++e-=Ag,据此确定溶液中银离子是否变化;电解稀硫酸时,实际上电解的是水,根据硫酸的浓度确定溶液pH值的变化;
(3)电解池阴极上析出银,根据转移电子数计算生成银的质量.
解答 解:根据题意知,电解稀硫酸时,实际上电解的是水,在c、d两极上共收集到336mL并且c少d多,则c收集的为氧气,d收集的为氢气,所以c为阳极,d为阴极,所以M为正极,N为负极,活性电极Ag作阳极,Pt电极作阴极即a作阳极,b为阴极;
(1)根据以上分析,N为负极;
故答案为:负;
(2)在铂电极上镀银时,阳极上的电极反应式为Ag-e-=Ag+,阴极上的电极反应式为Ag++e-=Ag,所以硝酸银溶液的浓度不变;电解稀硫酸溶液时,阴极发生2H++2e-═H2↑,阳极发生4OH--4e-═O2↑+2H2O,实际上电解的是水,溶液中的溶质不变,溶剂减少,导致稀硫酸的浓度增大,溶液的pH值减小;若要硫酸恢复成原溶液需加入H2O;
故答案为:不变;减小;H2O;
(2)电解稀硫酸反应时,当通电一段时间后,c、d两极共收集到336mL气体(标准状况),则阴极发生2H++2e-═H2↑,阳极发生4OH--4e-═O2↑+2H2O,实际上电解的是水,电池反应式为:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,根据方程式知,生成氢气的体积占总体积的$\frac{2}{3}$,所以混合气体中氢气的体积是224mL,根据2H++2e-═H2↑知,转移电子的物质的量是0.02mol,串联电解池中转移电子数相等,电镀池阴极上析出银的质量为
Ag++e-=Ag
1mol 108g
0.02mol 2.16g
故答案为:银; 2.16.
点评 本题以电解池原理为载体考查了物质的量的有关计算判断等知识点,明确发生的电极反应及电子守恒是解答本题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 质量为18g | B. | 含有NA个氧原子 | ||
| C. | 标准状况下体积约为22.4L | D. | 含有NA个水分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+HClO | |
| B. | 向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl- | |
| C. | NH4HCO3溶液和少量的NaOH溶液混合:HCO3-+OH-═CO32-+H2O | |
| D. | 向Fe(NO3)3溶液中加入足量的HI溶液:2Fe3++2I-=2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为35的氯原子:${\;}_{17}^{35}$Cl | B. | 氯化铵的电子式: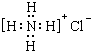 | ||
| C. | 硫化氢的结构式:H-S-H | D. | 二氧化硅的分子式:SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
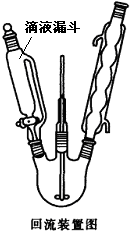 间硝基苯胺(Mr=128)是一种重要的染料中间体.它是一种黄色针状结晶,微溶于水,随温度升高溶解度增大,溶于乙醇、乙醚、甲醇.间硝基苯胺可选用间二硝基苯与碱金属多硫化物进行选择性还原(装置如右图所示),其反应式如下:
间硝基苯胺(Mr=128)是一种重要的染料中间体.它是一种黄色针状结晶,微溶于水,随温度升高溶解度增大,溶于乙醇、乙醚、甲醇.间硝基苯胺可选用间二硝基苯与碱金属多硫化物进行选择性还原(装置如右图所示),其反应式如下:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com