
 硝酸是一种重要的化工原料,工业上一般以氨气为原料来制备硝酸.请回答:
硝酸是一种重要的化工原料,工业上一般以氨气为原料来制备硝酸.请回答:分析 (1)CH4(g)+4NO2(g)?4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1①
CH4(g)+4NO(g)?2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1②
将方程式$\frac{①+②}{2}$得甲烷直接将NO2还原为N2的热化学方程式;
(2)燃料电池中,通入燃料的一极为负极,通入氧气的一极为正极,碱性条件下,氨气失电子生成氮气和水;
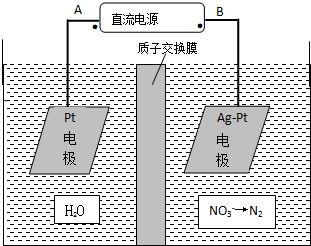
(3)①由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极;在阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有氢离子参与反应且有水生成;
②右侧电极上硝酸根离子得电子生成氮气,电极反应式为2NO3-+12H++10e-=N2↑+6H2O,左侧电极反应式为2H2O-4e-=O2↑+4H+,质子通过交换膜由左侧进入右侧,左侧溶液减少的质量是水的质量,右侧减少的质量氮气质量与进入氢离子质量之差.
解答 解:(1)CH4(g)+4NO2(g)?4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1①
CH4(g)+4NO(g)?2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1②
将方程式$\frac{①+②}{2}$CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=$\frac{-(574+1160)}{2}$kJ/mol=-867kJ•mol-1,
故答案为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ•mol-1;
(2)燃料电池中,通入燃料的一极为负极,通入氧气的一极为正极,则通入氨气的一极为负极,碱性条件下,氨气失电子生成氮气和水,其电极反应式为:2NH3-6e-+6OH-=N2+6H2O;
故答案为:负极;2NH3-6e-+6OH-=N2+6H2O;
(3)由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极;在阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有H2O参与反应且有水生成,所以阴极上发生的电极反应式为:2NO3-+12H++10e-=N2+6H2O,
故答案为:A;2NO3-+12H++10e-=N2+6H2O;
②右侧电极上硝酸根离子得电子生成氮气,电极反应式为2NO3-+12H++10e-=N2↑+6H2O,左侧电极反应式为2H2O-4e-=O2↑+4H+,质子通过交换膜由左侧进入右侧,左侧溶液减少的质量是水的质量,右侧减少的质量氮气质量与进入氢离子质量之差,若电解过程中转移了2mol电子,左侧减少质量=$\frac{2mol}{4}$×2×18g/mol=18g,左侧有4mol氢离子进入右侧,右侧减少质量=$\frac{2mol}{10}$×1×28g/mol-$\frac{2mol}{4}$×4×1g/mol=3.6g,所以膜两侧电解液的质量变化差(△m左-△m右)=18g-3.6g=14.4g,
故答案为:14.4.
点评 本题考查盖斯定律的应用、原电池原理和电解原理,题目难度中等,侧重考查学生分析计算能力,(3)中注意把握右侧减少质量实质,左侧生成的氢离子进入右侧溶液,所以导致右侧溶液减少质量不是氮气质量,为易错点.


科目:高中化学 来源: 题型:选择题

| A. | 当m2-m3=2.96 g时,Fe3O4的质量至少为2.32g | |
| B. | 生成蓝色溶液的离子方程式为Cu+2Fe3+═Cu2++2Fe2+ | |
| C. | 要确定混合物中是否含有Al,可取A加入适量稀盐酸 | |
| D. | 当m1>m2时,溶液a中的阴离子只有1种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
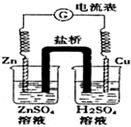
| A. | 随着反应进行,左烧杯中盐溶液浓度上升,右烧杯中酸溶液浓度下降 | |
| B. | 盐桥的作用是让电子通过,以构成闭合回路 | |
| C. | 随着反应进行,右烧杯中溶液pH变小 | |
| D. | 总反应为:2H++Zn═H2↑+Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
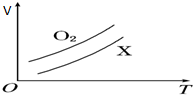 如图表示1g O2与1g X气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是( )
如图表示1g O2与1g X气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是( )| A. | C2H4 (气) | B. | SO2 | C. | CH4 | D. | NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在上述两个反应中,当有1molP参加反应时,反应转移电子数均为5NA | |
| B. | 在反应(2)中,当生成3mol硫酸时,被还原的P为1mol | |
| C. | 在上述两个反应中,P均作还原剂 | |
| D. | 在上述两个反应中,还原产物都是H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH中氢离子结构示意图: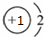 | B. | CH4分子的球棍模型: | ||
| C. | 醛基的电子式: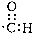 | D. | 对-硝基甲苯的结构简式: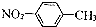 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙呈红色的溶液中:Fe2+、Na+、ClO-、SO42- | |
| B. | 在PH=3的溶液中:Mg2+、Al3+、NO3-、Cl- | |
| C. | 由水电离出的c(H+)=10-13mol•L-1的溶液中:Na+、SO32-、AlO2-、Br- | |
| D. | 加入铝粉后产生大量氢气的溶液中:NH4+、K+、NO3-、MnO4- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com