
【题目】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se.
完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2 , 且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的化学反应方程式
(2)已知:Se+2H2SO4(浓)═2SO2↑+SeO2+2H2O、2SO2+SeO2+2H2O═Se+2SO ![]() +4H+、SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是 .
+4H+、SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是 .
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO ![]() →Se+I2+KNO3+H2O②I2+2Na2S2O3═Na2S4O6+2NaI
→Se+I2+KNO3+H2O②I2+2Na2S2O3═Na2S4O6+2NaI
配平方程式①,标出电子转移的方向和数目
(4)实验中,准确称量SeO2样品0.1500g,消耗0.2000molL﹣1的Na2S2O3溶液25.00mL,所测定的样品中SeO2的质量分数为 .
【答案】
(1)Se+2HNO3(浓)═H2SeO3+NO↑+NO2↑
(2)H2SO4(浓)>SeO2>SO2
(3)![]()
(4)92.5%
【解析】解:(1.)利用题中信息可知Se与浓HNO3反应,Se被氧化为+4价的H2SeO3 , HNO3还原为NO与NO2 , 生成NO与NO2的物质的量之比为1:1,即二者计量系数比为1:1,令二者系数为1,根据电子转移守恒可知,Se的系数为 ![]() =1,故反应方程式为:Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑,
=1,故反应方程式为:Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑,
故答案为:Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑;
(2.)在氧化还原反应中,氧化剂的氧化性强于氧化产物的,所以根据反应的方程式可知,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>SO2 , 故答案为:H2SO4(浓)>SeO2>SO2;
(3.)在反应①中Se元素的化合价从+4价降低到0价,而碘元素的化合价从﹣1价升高到0价,所以根据电子的得失守恒,配平后的方程式是SeO2+4KI+4HNO3═Se+2I2+4KNO3+2H2O,反应中转移的电子数为4,则用单线桥表示为: ![]() ;
;
故答案为: ![]() ;
;
(4.)已知反应①SeO2+4KI+4HNO3═Se+2I2+4KNO3+2H2O,②I2+2Na2S2O3═Na2S4O6+2NaI,由电子的得失守恒可知,SeO2~2I2~4Na2S2O3 , 所以参加反应的SeO2的物质的量是0.200 0 molL﹣1×0.025 L× ![]() =0.001 25 mol,因此所测定的样品中SeO2的质量分数为
=0.001 25 mol,因此所测定的样品中SeO2的质量分数为 ![]() ×100%=92.5%;
×100%=92.5%;
故答案为:92.5%.
(1)利用题中信息可知Se与浓HNO3反应,Se被氧化为+4价的H2SeO3 , HNO3还原为NO与NO2 , 利用电子守恒和限定条件(生成NO与NO2的物质的量之比为1:1,即二者计量系数比为1:1)可得方程式;(2)在氧化还原反应中,氧化剂的氧化性强于氧化产物的,而还原剂的还原性强于还原产物的;(3)在反应①中Se元素的化合价从+4价降低到0价,而碘元素的化合价从﹣1价升高到0价,所以根据电子的得失守恒,配平后的方程式是SeO2+4KI+4HNO3═Se+2I2+4KNO3+2H2O,反应中转移的电子数为4;(4)根据反应①②及电子的得失守恒可知,SeO2~2I2~4Na2S2O3 , 所以参加反应的SeO2的物质的量是Na2S2O3的 ![]() ,然后求出质量和质量分数.
,然后求出质量和质量分数.


科目:高中化学 来源: 题型:
【题目】取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mLH2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液, 产生沉淀的量与所加NaOH溶液的体积的关系如图所示。则原H2SO4物质的量浓度是( )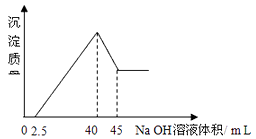
A.1mol/L
B.2mol/L
C.3mol/L
D.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 由H、D、T构成的氢分子有3种
B. H2、D2、T2互为同素异形体
C. H2、D2、T2在相同条件下的密度之比为1∶2∶3
D. 核聚变属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E 5种短周期元素,A与B可形成BA型化合物,且A元素是卤族元素中非金属性最强的元素;金属B的原子核内质子数比它前一周期同主族元素原子的质子数多8;C元素有3种同位素C1、C2、C3 , 其中自然界中含量最多的是C1 , C3原子的质量数是C1的3倍,C2原子的质量数是C1的2倍;D的气态氢化物的水溶液呈碱性,而其最高价氧化物对应的水化物为强酸;E元素为地壳中含量最多的元素。
(1)写出下列元素的元素符号:D , E。
(2)写出C1、C2、C3三种核素的符号:C1 , C2 , C3。
(3)E2-的离子结构示意图为。
(4)A与B形成的化合物的化学式是 ,
最常见的E与C2形成的分子中含个中子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水总量极大,金、铀等微量元素在海水中的总量自然也大,但从海水中获取这些微量元素的成本很高。其中成本最高的步骤在于( )
A. 从海水中富集含微量元素的化合物B. 使含微量元素的离子沉淀
C. 对含微量元素的混合物进行提纯D. 从化合物中冶炼这些单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T℃时,向2.0L恒容密闭容器中充入1.0molPCl5 , 反应PCl5(g) PCl3(g)+Cl2(g)经一段时间后达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是( )
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前50 s的平均速率为v(PCl3)=0.0032molL﹣1s﹣1
B.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11molL﹣1 , 则反应的△H<0
C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2 , 达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0molPCl5、2.0molCl2 , 达到平衡时,PCl5的转化率大于20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.试回答: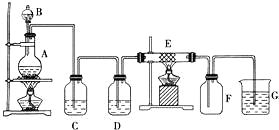
(1)C、G两个装置所盛放的试剂分别是: CG .
(2)①装置搭好须进行气密性检查,写出操作方法: .
②两处酒精灯应先点燃处(填写A或B),目的是 .
③F中的现象为 , G中出现了一种沉淀,该沉淀的化学式 .
(3)写出在A、E中发生反应的化学方程式为:
A: .
E: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:CO(g)+H2O(g)CO2(g)+H2(g),△H<0,在850℃,K=1,
(1)若升高到950℃,达到平衡时K1(填“大于”、“小于”或“等于”)
(2)在850℃,若向一容积可变的密闭容器中同时充入1molCO、3molH2O、1molCO2和xmol的H2: ①当x=5时,上述平衡向(填“正反应”或“逆反应”)方向进行
②若要使上述反应开始时向正反应方向进行,则x的取值为
③当x=5mol和x=6mol,上述反应达到平衡后,H2的体积分数分别为a%和b%,则a%b%(填“大于”、“小于”或“等于”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com