
【题目】有关物质的量的计算:
(1)2 mol尿素[CO(NH2)2]含__个H原子,所含氧原子跟_____g H2O所含氧原子个数相等。
(2)2.4g 镁中含______mol电子,在与足量盐酸反应中产生标准状况下的氢气体积为 ______L。
(3)30.9gNaR含有Na+ 0.3mol,则NaR的摩尔质量为_____。
【答案】8NA或 4.816×1024 36 1.2 2.24 103g·mol-1
【解析】
(1)2 mol尿素[CO(NH2)2]中氢原子的物质的量为2 mol×4=8mol,则含H原子8NA或 4.816×1024个;2 mol尿素[CO(NH2)2]中氧原子的物质的量为2 mol×1=2mol,所含氧原子为2NA,若与H2O所含氧原子个数相等,即H2O中氧原子的物质的量2mol,则水的物质的量为2mol,水的质量=2mol×18g/mol=36g,
答案为:8NA或 4.816×1024;36;
(2)2.4g镁的物质的量为![]() =0.1mol,一个镁原子含有12个电子,则镁原子含有0.1mol×12=1.2mol电子;根据反应Mg+2HCl=MgCl2+H2↑,0.1molMg完全反应生成0.1mol H2,标准状况下,0.1mol H2的体积为0.1mol×22.4L/mol=2.24L,
=0.1mol,一个镁原子含有12个电子,则镁原子含有0.1mol×12=1.2mol电子;根据反应Mg+2HCl=MgCl2+H2↑,0.1molMg完全反应生成0.1mol H2,标准状况下,0.1mol H2的体积为0.1mol×22.4L/mol=2.24L,
答案为:1.2;2.24;
(3)1molNaR含有1mol钠离子,则30.9gNaR含有Na+0.3mol,NaR物质的量为0.3mol,其摩尔质量为![]() =103g/mol,
=103g/mol,
答案为:103g/mol。


科目:高中化学 来源: 题型:
【题目】用间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图所示。下列说法正确的是
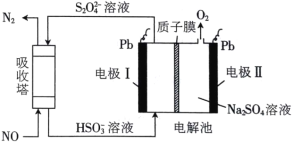
A. 电极I为阴极,电极反应式为2H2O+2e一=2OH-+H2↑
B. 电解时H+由电极I向电极II迁移
C. 吸收塔中的反应为2NO+2S2O42-+2H2O=N2+4HSO3-
D. 每处理1molNO,可同时得到32gO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
第二周期 | ① | ② | ③ | |||||
第三周期 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
第四周期 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:__(填元素符号),
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子__,碱性最强的化合物的电子式是:__。
(3)用电子式表示元素④与⑥的化合物的形成过程:__。
(4)表示①与⑦的化合物的电子式__,该化合物是由__(填“极性”或“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是_(用化学式表示)。
(6)元素③的简单氢化物的结构式__,在常温下和元素⑦的单质反应的离子方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
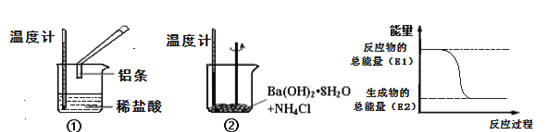
【题目】某实验小组同学进行如下实验,以检验化学反应中的能量变化。
(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是__热反应,Ba(OH)28H2O与NH4Cl反应时,需要将固体研细其目的是_。反应过程__(填“①”或“②”)的能量变化可用图表示。
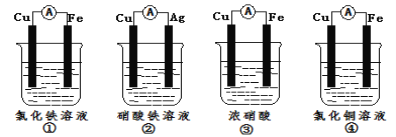
(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是_(填序号)。
(3)将CH4设计成燃料电池,其利用率更高,装置如图所示(a、b为多孔碳棒)其中_(填A或B)处电极入口通甲烷,当消耗标况下甲烷33.6L时,假设能量转化率为90%,则导线中转移电子的物质的量为__mol。
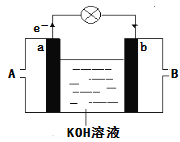
(4)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
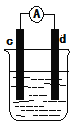
①当电极c为Al、电极d为Cu、电解质溶液为稀硫酸时,写出该原电池正极的电极反应式为__。
②当电极c为Al、电极d为Mg、电解质溶液为氢氧化钠溶液时,该原电池的负极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能说明反应X(g)+2Y(g)![]() 2Z(g)达到化学平衡状态的是( )
2Z(g)达到化学平衡状态的是( )
A..X、Y、Z的物质的量之比为1:2:2
B.X、Y、Z的浓度不再发生变化
C.反应速率v(X)=v(Y)
D.单位时间内生成nmolX的同时生成2nmolY
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或现象不能用平衡移动原理解释的是
A. 卤化银沉淀的转化

B. 配制FeCl3溶液
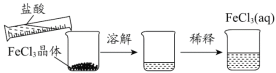
C. 淀粉在不同条件下水解
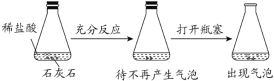
D. 探究石灰石与稀盐酸在密闭环境下的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成乙酸乙酯的路线如下:
CH2=CH2![]() C2H5OH
C2H5OH![]() CH3CHO
CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
请回答下列问题:
(1)写出乙烯的电子式_____________________________________。
(2)C2H5OH、 CH3COOH分子中的官能团名称分别是____________、____________。
(3)写出下列反应的反应类型:①______________,②_____________。
(4)乙烯能发生聚合反应,其产物的结构简式为______________.
(5)写出下列反应的化学方程式.
反应②:__________________________。
反应④:___________________________。
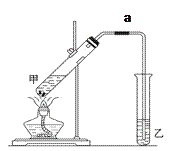
(6)实验室用如图装置制备乙酸乙酯:
甲试管中碎瓷片的作用是______;导管a的作用是_______________。
乙试管中饱和碳酸钠溶液的作用是:________ ; ________ ;
该装置图中有一个明显的错误是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度分别为T1和T2时,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g),一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g),一段时间后达到平衡,反应过程中测定的数据如下表:
温度/K | t/min | t1 | t2 | t3 | t4 |
T1 | n(Y)/mol | 0.14 | 0.12 | 0.10 | 0.10 |
T2 | n(Y)/mol | 0.13 | 0.09 | 0.08 |
下列说法正确的是( )
A. 该反应的正反应为放热反应
B. T2温度下此反应的平衡常数K=4
C. 温度为T1时,0~t1时间段的平均速率υ(Z)=2.0×10-3mol·L-1·min-1
D. 在T1下平衡后,保持其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com